题目内容
一氧化碳能在高温下还原铁矿石中的氧化铁.现用200t 含氧化铁80%的铁矿石炼铁,可炼出含铁95%的生铁多少吨?
(1)请你根据化学方程式进行计算.
(2)本题还有其他解法吗?若有,只要求说明依据并列出算式.若没有,可不回答此问.
解:(1)设可炼出含铁95%的生铁x吨,
则3CO+Fe2O3 2Fe+3CO2
2Fe+3CO2
160 112
200t×80% x×95%
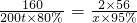 ,
,
解得x=117.9t,
答:可炼出含铁95%的生铁117.9t.
(2)由于矿石中的铁元素的质量在反应后全部以单质铁存在,
设可炼出含铁95%的生铁xt,则根据铁元素的质量守恒可知,
200t×80%× ×100%=x×95%.
×100%=x×95%.
分析:根据一氧化碳能在高温下还原铁矿石中的氧化铁的化学反应方程式,将氧化铁的质量代入化学反应方程式来计算,也可利用铁元素质量守恒的方法来计算.
点评:本题考查含有杂质物质的化学反应的计算,学生应注意纯物质的纯质量可代入化学反应方程式来计算,并注意计算格式规范.
则3CO+Fe2O3
 2Fe+3CO2
2Fe+3CO2160 112
200t×80% x×95%
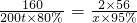 ,
,解得x=117.9t,
答:可炼出含铁95%的生铁117.9t.
(2)由于矿石中的铁元素的质量在反应后全部以单质铁存在,
设可炼出含铁95%的生铁xt,则根据铁元素的质量守恒可知,
200t×80%×
 ×100%=x×95%.
×100%=x×95%.分析:根据一氧化碳能在高温下还原铁矿石中的氧化铁的化学反应方程式,将氧化铁的质量代入化学反应方程式来计算,也可利用铁元素质量守恒的方法来计算.
点评:本题考查含有杂质物质的化学反应的计算,学生应注意纯物质的纯质量可代入化学反应方程式来计算,并注意计算格式规范.

练习册系列答案
相关题目
氮化铝(AlN)是新型的电子绝缘基片材料,用于大型和超大
型集成电路中.在高温下氮气、碳和三氧化二铝反应可以生成氮化铝微晶粉体和一氧化碳,用此方法制得的氮化铝中含有少量杂质碳和氧化铝.某校化学兴趣小组利用上述反应原理制取并测定所得样品中氮化铝的质量分数.
查阅资料:(1)Al2O3+2NaOH=2NaAlO2+H2O; (2)AlN+NaOH+H2O=NaAlO2+NH3↑.氨气易与酸反应.
设计实验:
实验一:制取氮化铝样品
实验二:测定所制氮化铝样品中氮化铝的质量分数
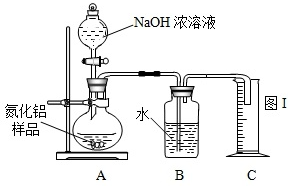
①按图2组装仪器,将9.1g氮化铝样品放入锥形瓶中,在分液漏斗中加入一定量的浓NaOH溶液
②称得盛有稀盐酸的烧杯和漏斗的总质量为200g
③打开止水夹C,从分液漏斗向锥形瓶中滴入浓NaOH溶液,直到不再产生气体为止
④打开止水夹B,从导管A处缓缓鼓入一定量的空气
⑤再次称量盛有稀盐酸的烧杯和漏斗的质量和为203.4g
⑥重复实验④⑤步骤后称得盛有稀盐酸的烧杯和漏斗的总质量仍为203.4g
实验讨论:(1)步骤①加入样品前还应检查 .
(2)装有碱石灰的干燥管作用是 ;装置中使用漏斗的目的是 .
(3)图2烧杯中稀盐酸不能换成浓盐酸的理由是 ;图2烧杯中稀盐酸不能换成浓硫酸的理由是 ;图2烧杯中稀盐酸能否换成稀硫酸 .
(4)步骤④的目的是 .
实验结论:所制氮化铝样品中氮化铝的质量分数为 %(写计算过程,4分).
事故处理:实验中,小明不小心将盛有约50mL的浓NaOH溶液打翻在桌面上.这时他应该采取的措施是: .
拓展探究:(1)实验后剩余的浓NaOH溶液 (能或不能)放回原试剂瓶,写出NaOH溶液露置在空气中发生的化学反应方程式 .
(2)本着节约药品的原则,同时又要确保实验顺利获得成功.则实验二中至少应准备40%浓NaOH溶液 g(写计算过程,4分).
型集成电路中.在高温下氮气、碳和三氧化二铝反应可以生成氮化铝微晶粉体和一氧化碳,用此方法制得的氮化铝中含有少量杂质碳和氧化铝.某校化学兴趣小组利用上述反应原理制取并测定所得样品中氮化铝的质量分数.
查阅资料:(1)Al2O3+2NaOH=2NaAlO2+H2O; (2)AlN+NaOH+H2O=NaAlO2+NH3↑.氨气易与酸反应.
设计实验:
实验一:制取氮化铝样品
| 实验步骤 | 相关化学反应方程式 | ||||
| 1.除去空气中粉尘、二氧化碳、干燥后,再除去氧气. | 除去氧气的化学反应方程式为 2Cu+O2
| ||||
| 2.用上述制得的氮气通入装有碳和三氧化二铝硬质玻璃管中高温制取氮化铝样品(如图1). | 装置中发生化学反应的化学方程式为 N2+3C+Al2O3
|
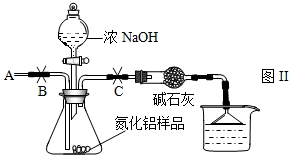
①按图2组装仪器,将9.1g氮化铝样品放入锥形瓶中,在分液漏斗中加入一定量的浓NaOH溶液
②称得盛有稀盐酸的烧杯和漏斗的总质量为200g
③打开止水夹C,从分液漏斗向锥形瓶中滴入浓NaOH溶液,直到不再产生气体为止
④打开止水夹B,从导管A处缓缓鼓入一定量的空气
⑤再次称量盛有稀盐酸的烧杯和漏斗的质量和为203.4g
⑥重复实验④⑤步骤后称得盛有稀盐酸的烧杯和漏斗的总质量仍为203.4g
实验讨论:(1)步骤①加入样品前还应检查
(2)装有碱石灰的干燥管作用是
(3)图2烧杯中稀盐酸不能换成浓盐酸的理由是
(4)步骤④的目的是
实验结论:所制氮化铝样品中氮化铝的质量分数为
事故处理:实验中,小明不小心将盛有约50mL的浓NaOH溶液打翻在桌面上.这时他应该采取的措施是:
拓展探究:(1)实验后剩余的浓NaOH溶液
(2)本着节约药品的原则,同时又要确保实验顺利获得成功.则实验二中至少应准备40%浓NaOH溶液

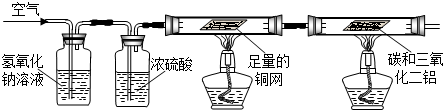
 某日,我校化学兴趣小组的同学甲、乙、丙在做木炭和氧化铜反应的实验.
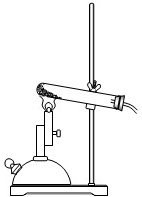
某日,我校化学兴趣小组的同学甲、乙、丙在做木炭和氧化铜反应的实验.操作如下:把经过烘干的过量的木炭粉和少量的氧化铜粉末混合均匀,小心地平铺在硬质试管底部,并将硬质试管固定在铁架台上,然后用酒精喷灯加热(如图装置所示). 加热一段时间后发现有红色固体出现,同时有气体喷出,这气体的成分是什么?
三位同学展开了分析、讨论.
(1)甲、乙两位同学根据已有的知识很快作出自己的判断并设计实验去验证:
甲:认为该气体只是CO2,乙:认为该气体只是CO.
丙同学查阅资料得知:碳在高温下,不但能跟金属氧化物反应,夺取其中的氧,生成二氧化碳;还能夺取二氧化碳中的氧,生成一氧化碳.
(2)丙认为在这个反应里甲、乙两位同学的结论不完全正确,于是提出自己的假设,你认为丙同学有可能提出的假设是
(3)丙同学设计了如下实验,请你完成相关的实验报告
| 实验步骤 | 实验现象 | 实验结论 |
| ①将气体通入到装有少量澄清石灰水的试管中 | 石灰水变浑浊 | 证明气体含有 |
| ②点燃尾气 | 尾气能燃烧 | 证明气体含有 |
(4)在装置A的试管中发生反应的化学方程式有:①
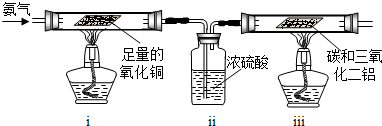
 李洋同学在实验室用木炭和氧化铜两种黑色粉末在高温下反应制取单质铜,反应的化学方程式为:C+2CuO
李洋同学在实验室用木炭和氧化铜两种黑色粉末在高温下反应制取单质铜,反应的化学方程式为:C+2CuO I.(1)写出以赤铁矿为原料在高温下制取铁的化学方程式:
I.(1)写出以赤铁矿为原料在高温下制取铁的化学方程式: