题目内容
金属与化合物溶液的反应
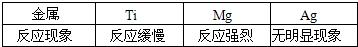
(1)铁丝浸入硫酸铜溶液中,现象为浸入溶液中的铁钉表面覆盖______,溶液由______逐渐变为______,反应的化学方程式为______,反应后金属的质量______,溶液的质量______.能否有铁制品盛放硫酸铜溶液(或农药波尔多液)______.
(2)铝丝浸入硫酸铜溶液中,现象为浸入溶液的铝丝表面覆盖一层紫红色的物质,溶液由______逐渐变为______;反应的化学方程式为______,反应后金属的质量______,溶液的质量______.
(3)铜丝浸入硝酸银溶液中,现象为浸入溶液中的铜丝表面覆盖______,溶液由______逐渐变为______;反应的化学方程式为______,反应后金属的质量______,溶液的质量______.
(4)结论:①根据以上实验,说明铝、铁、铜、银四种金属的活动性由强到弱的顺序为:______;
②______的金属能把______的金属从其化合物溶液中置换出来.
(5)注意:①此类反应一定在溶液中进行,______的化合物一般不与金属反应.
②K、Ca、Na活动性非常强,能同溶液中的水剧烈反应,不能用它们置换化合物溶液中的金属.
(6)置换反应:由______与一种______反应,生成另一种______的反应叫做置换反应.
(1)铁丝浸入硫酸铜溶液中,现象为浸入溶液中的铁钉表面覆盖______,溶液由______逐渐变为______,反应的化学方程式为______,反应后金属的质量______,溶液的质量______.能否有铁制品盛放硫酸铜溶液(或农药波尔多液)______.
(2)铝丝浸入硫酸铜溶液中,现象为浸入溶液的铝丝表面覆盖一层紫红色的物质,溶液由______逐渐变为______;反应的化学方程式为______,反应后金属的质量______,溶液的质量______.
(3)铜丝浸入硝酸银溶液中,现象为浸入溶液中的铜丝表面覆盖______,溶液由______逐渐变为______;反应的化学方程式为______,反应后金属的质量______,溶液的质量______.
(4)结论:①根据以上实验,说明铝、铁、铜、银四种金属的活动性由强到弱的顺序为:______;
②______的金属能把______的金属从其化合物溶液中置换出来.
(5)注意:①此类反应一定在溶液中进行,______的化合物一般不与金属反应.
②K、Ca、Na活动性非常强,能同溶液中的水剧烈反应,不能用它们置换化合物溶液中的金属.
(6)置换反应:由______与一种______反应,生成另一种______的反应叫做置换反应.
(1)铁能与硫酸铜反应生成硫酸亚铁和铜,
Fe+CuSO4═FeSO4+Cu
56 160 152 64
硫酸铜溶液为蓝色,硫酸亚铁溶液颜色为浅绿色,参加反应的硫酸铜的质量为160,参加反应的硫酸亚铁的质量为152,故溶液的质量减小,生成的铜覆盖在铁的表面,参加反应的铁的质量为56,生成的铜的质量为64,故金属的质量增加,所以本题答案为:红色物质,蓝色,浅绿色,Fe+CuSO4═FeSO4+Cu,增加,减小,不能;
(2)铝能与硫酸铜反应生成硫酸铝和铜,
2Al+3CuSO4═Al2(SO4)3+3Cu
54 480 342 192
硫酸铝溶液颜色为无色,生成的铜覆盖在铝的表面,参加反应的铝的质量为54,生成的铜的质量为192,故金属的质量增加,参加反应的硫酸铜的质量为480,生成的硫酸铝的质量为342,故溶液的质量减小,所以本题答案为:蓝色,无色,2Al+3CuSO4═Al2(SO4)3+3Cu,增加,减小;
(3)铜能与硝酸银反应生成硝酸铜和银,
Cu+2AgNO3═Cu(NO3)2+2Ag
64 340 188 216
硝酸银溶液为无色,硝酸铜溶液为蓝色,生成的银覆盖在铜的表面,参加反应的铜的质量为64,生成的银的质量为216,故金属的质量增加,参加反应的硝酸银的质量为340,生成的硝酸铜的质量为216,故溶液的质量减小,所以本题答案为:银白色物质,无色,蓝色,Cu+2AgNO3═Cu(NO3)2+2Ag,增加,减少;
(4)根据以上实验可以看出,位置在前的金属能将位于其后的金属从其盐溶液中置换出来,这四种金属的活动性顺序为铝>铁>铜>银,所以本题答案为:①铝>铁>铜>银,②位置在前,位于其后;
(5)金属与盐发生置换反应时,盐必须是可溶性盐,所以本题答案为:不溶于水;
(6)置换反应是指一种单质与一种化合物反应生成另一种单质和另一种化合物的反应,所以本题答案为:一种单质,化合物,单质和另一种化合物.
Fe+CuSO4═FeSO4+Cu
56 160 152 64
硫酸铜溶液为蓝色,硫酸亚铁溶液颜色为浅绿色,参加反应的硫酸铜的质量为160,参加反应的硫酸亚铁的质量为152,故溶液的质量减小,生成的铜覆盖在铁的表面,参加反应的铁的质量为56,生成的铜的质量为64,故金属的质量增加,所以本题答案为:红色物质,蓝色,浅绿色,Fe+CuSO4═FeSO4+Cu,增加,减小,不能;
(2)铝能与硫酸铜反应生成硫酸铝和铜,
2Al+3CuSO4═Al2(SO4)3+3Cu
54 480 342 192
硫酸铝溶液颜色为无色,生成的铜覆盖在铝的表面,参加反应的铝的质量为54,生成的铜的质量为192,故金属的质量增加,参加反应的硫酸铜的质量为480,生成的硫酸铝的质量为342,故溶液的质量减小,所以本题答案为:蓝色,无色,2Al+3CuSO4═Al2(SO4)3+3Cu,增加,减小;
(3)铜能与硝酸银反应生成硝酸铜和银,
Cu+2AgNO3═Cu(NO3)2+2Ag
64 340 188 216
硝酸银溶液为无色,硝酸铜溶液为蓝色,生成的银覆盖在铜的表面,参加反应的铜的质量为64,生成的银的质量为216,故金属的质量增加,参加反应的硝酸银的质量为340,生成的硝酸铜的质量为216,故溶液的质量减小,所以本题答案为:银白色物质,无色,蓝色,Cu+2AgNO3═Cu(NO3)2+2Ag,增加,减少;
(4)根据以上实验可以看出,位置在前的金属能将位于其后的金属从其盐溶液中置换出来,这四种金属的活动性顺序为铝>铁>铜>银,所以本题答案为:①铝>铁>铜>银,②位置在前,位于其后;
(5)金属与盐发生置换反应时,盐必须是可溶性盐,所以本题答案为:不溶于水;
(6)置换反应是指一种单质与一种化合物反应生成另一种单质和另一种化合物的反应,所以本题答案为:一种单质,化合物,单质和另一种化合物.

练习册系列答案
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案
相关题目
某化学研究小组进行研究性学习,请你协助完成相关任务.
【研究课题1】探究水壶内部水垢的主要成分
【查阅资料】(1)天然水中含有Ca2+、Mg2+、HCO3-等离子,在加热条件下,这些离子趋于生成溶解度更小的物质--水垢(主要成分为碳酸盐和碱).天然水和水垢所含的物质及其溶解性如下表:
【提出猜想】水垢的主要成分一定含有Mg(OH)2和______,可能含有Ca(OH)2和MgCO3.
【设计方案】
(1)甲同学在烧杯中放入少量研碎的水垢,加入适量蒸馏水充分搅拌,静置.取上层清液滴入Na2CO3溶液,如果没有白色沉淀,说明水垢中无______(填化学式).
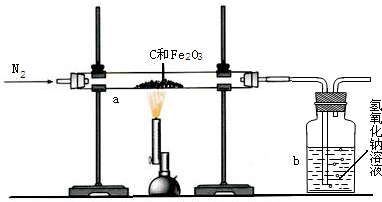
(2)乙同学设计了下列实验装置,进一步确定水垢中含有碳酸盐的成分.

其主要实验步骤如下:
①按图组装仪器,将50g水垢试样放入锥形瓶中,逐滴加入足量稀盐酸.
②待锥形瓶中不再产生气泡时,打开活塞b,从导管a处缓缓鼓入一定量的空气,使装置内的气体缓缓通过后面的装置.
③称量D瓶内物质增加的质量;
④重复②和③的操作,直至D瓶内物质质量不变.
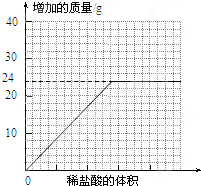
测量滴加稀盐酸体积与D瓶内物质增加质量的关系如图曲线所示;

【思考与评价】
(1)当水中含较多可溶性钙、镁化合物的水叫硬水,生活中降低水的硬度的常用方法是:______.
(2)A瓶中的NaOH溶液作用是______.
(3)若50g水垢全部是碳酸钙,则最终应该产生二氧化碳的质量是______g.
(4)一般情况下,两种不同金属形成的碳酸盐与足量盐酸反应时,若两金属的化合价相同、两种盐的质量相同,则相对分子质量小者放出的气体多.分析曲线图可知:水垢中一定含有______(化学式),理由是______.
(5)以上实验______(填“能够”或“不能”)检测出水垢中含有Mg(OH)2.
【研究课题2】为测定氯化钠样品的纯度,取30g氯化钠样品(杂质为氯化钙)溶于水配制成263g溶液,再加入53g溶质质量分数为20%的碳酸钠溶液,恰好完全反应.求:反应后所得溶液中溶质的质量分数.
【研究课题1】探究水壶内部水垢的主要成分
【查阅资料】(1)天然水中含有Ca2+、Mg2+、HCO3-等离子,在加热条件下,这些离子趋于生成溶解度更小的物质--水垢(主要成分为碳酸盐和碱).天然水和水垢所含的物质及其溶解性如下表:
| 物 质 | Ca(HCO3)2 | Mg(HCO3)2 | Ca(OH)2 | Mg(OH)2 | CaCO3 | MgCO3[来源:] |
| 溶解性 | 可溶 | 可溶 | 微溶 | 不溶 | 不溶 | 微溶 |
【设计方案】
(1)甲同学在烧杯中放入少量研碎的水垢,加入适量蒸馏水充分搅拌,静置.取上层清液滴入Na2CO3溶液,如果没有白色沉淀,说明水垢中无______(填化学式).
(2)乙同学设计了下列实验装置,进一步确定水垢中含有碳酸盐的成分.

其主要实验步骤如下:
①按图组装仪器,将50g水垢试样放入锥形瓶中,逐滴加入足量稀盐酸.
②待锥形瓶中不再产生气泡时,打开活塞b,从导管a处缓缓鼓入一定量的空气,使装置内的气体缓缓通过后面的装置.
③称量D瓶内物质增加的质量;
④重复②和③的操作,直至D瓶内物质质量不变.
测量滴加稀盐酸体积与D瓶内物质增加质量的关系如图曲线所示;

【思考与评价】
(1)当水中含较多可溶性钙、镁化合物的水叫硬水,生活中降低水的硬度的常用方法是:______.
(2)A瓶中的NaOH溶液作用是______.
(3)若50g水垢全部是碳酸钙,则最终应该产生二氧化碳的质量是______g.
(4)一般情况下,两种不同金属形成的碳酸盐与足量盐酸反应时,若两金属的化合价相同、两种盐的质量相同,则相对分子质量小者放出的气体多.分析曲线图可知:水垢中一定含有______(化学式),理由是______.
(5)以上实验______(填“能够”或“不能”)检测出水垢中含有Mg(OH)2.
【研究课题2】为测定氯化钠样品的纯度,取30g氯化钠样品(杂质为氯化钙)溶于水配制成263g溶液,再加入53g溶质质量分数为20%的碳酸钠溶液,恰好完全反应.求:反应后所得溶液中溶质的质量分数.

 CO+H2 ③CO+H2O==CO2+H2
CO+H2 ③CO+H2O==CO2+H2
