题目内容
 人的胃液里含有适量的盐酸,可帮助消化,但如果分泌过多,人会感到胃痛.小军拿来了一种治疗胃酸过多的药物,该药物说明书的部分内容如图所示.
人的胃液里含有适量的盐酸,可帮助消化,但如果分泌过多,人会感到胃痛.小军拿来了一种治疗胃酸过多的药物,该药物说明书的部分内容如图所示.
(1)为了验证该药物的主要成分是碳酸镁,通过查阅资料得知其性质与CaCO3相似,于是他首先将药片放入试管中,向其中加入适量的稀盐酸,并在试管口塞一个带导管的橡皮塞,导管的一端通入________,实验现象为________
请你写出碳酸镁与稀盐酸的化学方程式________
(2)小军看到说明书上的服用方法后,对此产生了探究的兴趣,请你和他一起完成探究活动.
提出问题:抗酸药为什么嚼碎后服用?
作出猜想:他的猜想是________
设计实验:
实验一:将一片完整的药片放入试管中,向其中加入5ml的稀盐酸;
实验二:将________放入试管中,向其中加入与实验一相同浓度相同体积的稀盐酸;
现象与结论:实验二比实验一反应快.证明小军的猜想正确.
(3)拓展探究:
①氢氧化镁、碳酸钙、碳酸氢钠等也常用于制作抗酸药,这些物质必须具备两个条件:一是能与胃酸作用;二是________.
②患有胃溃疡(胃黏膜溃烂)的病人胃酸过多时,不宜服用含碳酸盐的抗酸药,其原因是________.
③你还能写出稀盐酸与碳酸氢钠反应的方程式吗?请写出来.________
(4)小军为了进一步测定该药品中碳酸镁的含量,取十片该药品称量,重10g,放入烧杯中,滴加质量分数7.3%的盐酸,直至恰好完全反应,共消耗盐酸100g,根据以上数据,请你计算该药品中碳酸镁的质量分数.
解:(1)该药物的主要成分是碳酸盐,先将药片放入试管中,向其中加入适量的稀盐酸,然后验证生成的气体是不是二氧化碳就行;碳酸镁能够和稀盐酸反应生成二氧化碳气体,其化学方程式为MgCO3+2HCl═MgCl2+H2O+CO2↑;
故答案为:澄清的石灰水中;石灰水变浑浊;MgCO3+2HCl═MgCl2+H2O+CO2↑;
(2)药物说明书上的服用方法是嚼碎后服用,故他猜想的是:嚼碎后服用疗效快;
分别让整片的药片和研碎的药片与盐酸反应,观察反应速度,从而得出小军的猜想正确.
故答案为:嚼碎后服用疗效快;一片研碎的药片;
(3)①最后深入探究得出胃药必备的条件:一能中和胃酸,二对身体无害;
故答案为:对身体无害;
②由于这些碳酸盐与胃酸反应能产生二氧化碳气体,加重胃溃疡病情,所以患有胃溃疡(胃黏膜溃烂)的病人胃酸过多时,不宜服用含碳酸盐的抗酸药;
故答案为:碳酸盐与胃酸作用生成二氧化碳气体,加重胃溃疡病情;
③碳酸氢钠与盐酸反应生成氯化钠、水、二氧化碳,故答案是:HCl+NaHCO3=NaCl+H2O+CO2↑.
(4)设碳酸镁的质量是x,
MgCO3+2HCl=MgCl2+H2O+CO2↑
84 73
x 100g×7.3%
 =
=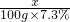
解得x=8.4g
所以该药品中碳酸镁的质量分数为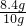 ×100%=84%.
×100%=84%.
答:该药品中碳酸镁的质量分数为84%.
分析:该题是典型的实验探究题,以小军吃胃痛药为背景,来探究胃药成分,进而探究抗酸药为什么嚼碎后服用?通过猜想,实验,得出了吃胃药的方法以及胃药的特点和注意事项,最后通过有关化学方程式的简单计算来计算药物中碳酸镁的质量分数.
点评:该题最大的特点是通过问题情境,将胃药说明书探究的明明白白,使学生在做题中获得了生活常识,很有意义.
故答案为:澄清的石灰水中;石灰水变浑浊;MgCO3+2HCl═MgCl2+H2O+CO2↑;
(2)药物说明书上的服用方法是嚼碎后服用,故他猜想的是:嚼碎后服用疗效快;
分别让整片的药片和研碎的药片与盐酸反应,观察反应速度,从而得出小军的猜想正确.
故答案为:嚼碎后服用疗效快;一片研碎的药片;
(3)①最后深入探究得出胃药必备的条件:一能中和胃酸,二对身体无害;
故答案为:对身体无害;
②由于这些碳酸盐与胃酸反应能产生二氧化碳气体,加重胃溃疡病情,所以患有胃溃疡(胃黏膜溃烂)的病人胃酸过多时,不宜服用含碳酸盐的抗酸药;
故答案为:碳酸盐与胃酸作用生成二氧化碳气体,加重胃溃疡病情;
③碳酸氢钠与盐酸反应生成氯化钠、水、二氧化碳,故答案是:HCl+NaHCO3=NaCl+H2O+CO2↑.
(4)设碳酸镁的质量是x,
MgCO3+2HCl=MgCl2+H2O+CO2↑
84 73
x 100g×7.3%
 =
=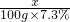
解得x=8.4g
所以该药品中碳酸镁的质量分数为
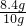 ×100%=84%.
×100%=84%.答:该药品中碳酸镁的质量分数为84%.
分析:该题是典型的实验探究题,以小军吃胃痛药为背景,来探究胃药成分,进而探究抗酸药为什么嚼碎后服用?通过猜想,实验,得出了吃胃药的方法以及胃药的特点和注意事项,最后通过有关化学方程式的简单计算来计算药物中碳酸镁的质量分数.
点评:该题最大的特点是通过问题情境,将胃药说明书探究的明明白白,使学生在做题中获得了生活常识,很有意义.

练习册系列答案
相关题目
 17、人的胃液里含有适量的盐酸,可以帮助消化,但如果胃酸分泌过多,人会感到胃痛.小军拿来了一种抗酸药(治疗胃酸过多的药物),该药物说明书的部分内容如图所示.当小军看到药物说明书上的服用方法后,对此产生了探究的兴趣,请你和他一起完成探究活动.
17、人的胃液里含有适量的盐酸,可以帮助消化,但如果胃酸分泌过多,人会感到胃痛.小军拿来了一种抗酸药(治疗胃酸过多的药物),该药物说明书的部分内容如图所示.当小军看到药物说明书上的服用方法后,对此产生了探究的兴趣,请你和他一起完成探究活动. 16、人的胃液里含有适量的盐酸,可以帮助消化,
16、人的胃液里含有适量的盐酸,可以帮助消化,
