题目内容
氯酸钾和二氧化锰的混合物6.40g,充分加热后,剩下固体4.48g求:
(1)根据质量守恒定律,可制得氧气 g;
(2)原混合物中二氧化锰的质量是多少?
【答案】分析:(1)根据质量守恒定律,生成氧气的质量=反应前物质质量总和-反应后物质质量总和;
(2)利用氯酸钾受热分解的化学方程式和生成氧气的质量,列出比例式,就可计算出参与反应的氯酸钾质量;在此反应中,二氧化锰是催化剂,反应前后质量不变.混合物的质量减去氯酸钾质量就是二氧化锰的质量.
解答:解:(1)根据质量守恒定律,生成氧气的质量=6.40g-4.48g=1.92g;
(2)设参与反应的氯酸钾质量为x,
2KClO3 2KCl+3O2↑
2KCl+3O2↑
245 96
x 1.92g
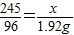
x=4.9g;
则原混合物中二氧化锰的质量为:6.40g-4.9g=1.5g.
故答案为:(1)1.92;(2)原混合物中二氧化锰的质量为1.5g;
点评:本题主要考查学生利用化学方程式和质量守恒定律解答问题的能力.解题的关键是根据质量守恒定律求出生成氧气的质量;
(2)利用氯酸钾受热分解的化学方程式和生成氧气的质量,列出比例式,就可计算出参与反应的氯酸钾质量;在此反应中,二氧化锰是催化剂,反应前后质量不变.混合物的质量减去氯酸钾质量就是二氧化锰的质量.
解答:解:(1)根据质量守恒定律,生成氧气的质量=6.40g-4.48g=1.92g;
(2)设参与反应的氯酸钾质量为x,
2KClO3
 2KCl+3O2↑
2KCl+3O2↑245 96
x 1.92g
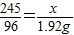
x=4.9g;
则原混合物中二氧化锰的质量为:6.40g-4.9g=1.5g.
故答案为:(1)1.92;(2)原混合物中二氧化锰的质量为1.5g;
点评:本题主要考查学生利用化学方程式和质量守恒定律解答问题的能力.解题的关键是根据质量守恒定律求出生成氧气的质量;

练习册系列答案
 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案
相关题目