题目内容
(2008?浦东新区二模)今天是实验室的开放日,某小组的同学利用下列装置进行实验.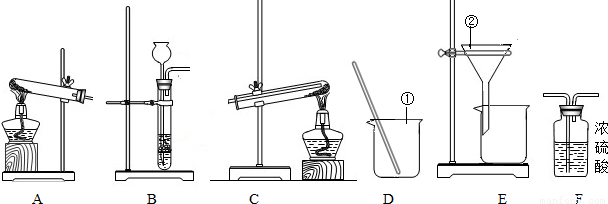
(1)写出图中指定仪器的名称:①;②;
(2)要制取干燥的H2,并用H2还原氧化铜,应选取的装置为(填装置编号).在氢气还原氧化铜的过程中,同学们能观察到的现象是.
(3)若制取氢气时需要100g 9.8%的稀硫酸,配制上述稀硫酸需要98%的浓硫酸(密度为1.84g/cm3)mL.配制过程中,除上图装置中的仪器外,还缺少的仪器有(填序号).
①天平 ②胶头滴管 ③药匙 ④10mL量筒 ⑤100mL量筒
(4)还原氧化铜的实验结束后,同学们发现得到的铜中还混有未反应的氧化铜.为了得到纯净的铜,他们进行了以下实验操作:
| 操作 | 简答 |
| ①将反应后的固体放入烧杯中,加入足量的稀硫酸,搅拌,使其充分反应. | 加足量稀硫酸的目的是: |
| ②将操作①所得的混合物过滤. | 滤液中所含有的溶质是: |
| ③将操作②所得的滤渣洗涤、烘干,得到纯净的铜, |
【答案】分析:(1)写出常见化学仪器名称;
(2)选择固液常温反应装置制氢气及干燥方法,熟悉氢气还原氧化铜的实验装置及反应现象;
(3)掌握稀释浓硫酸的方法及所需仪器,根据稀释前后容质量不变计算所需浓硫酸的质量,由密度求其体积量;
(4)熟悉一些分离混合物的方法,掌握一些硫酸的化学性质.
解答:解:(1)题干中指定的仪器名称是①烧杯、②漏斗;
(2)实验室制取氢气常用锌和稀硫酸反应,采用固液反应装置,干燥氢气常用浓硫酸,因其具吸水性,氢气还原氧化铜固体需将导气管通入试管底部氧化铜的上方加热,故应选装置B、F、C;反应时会出现黑色固体变红色,试管口有水滴生成的现象;
(3)稀释浓硫酸时,根据稀释前后容质量不变计算所需浓硫酸的质量,再由密度求其体积量,即:100g×9.8%═浓硫酸质量×98%,浓硫酸质量═10g,由密度公式求得浓硫酸体积═5.4mL,稀释浓硫酸用到烧杯、玻璃棒、胶头滴管、量筒,故缺少仪器选②④⑤.
(4)
故答案为:
(1)①烧杯、②漏斗;
(2)B、F、C;黑色固体变红色,试管口有水滴;
(3)5.4;②④⑤;
(4)
点评:此题考查了常用仪器的识别与书写,氢气的实验室制法、干燥方法及其还原性,有关溶液的稀释计算及配制溶液的方法、所需仪器的熟悉了解,混合物的分离等知识,涉及知识面广,能很好的培养学生的知识掌握能力.
(2)选择固液常温反应装置制氢气及干燥方法,熟悉氢气还原氧化铜的实验装置及反应现象;
(3)掌握稀释浓硫酸的方法及所需仪器,根据稀释前后容质量不变计算所需浓硫酸的质量,由密度求其体积量;
(4)熟悉一些分离混合物的方法,掌握一些硫酸的化学性质.
解答:解:(1)题干中指定的仪器名称是①烧杯、②漏斗;
(2)实验室制取氢气常用锌和稀硫酸反应,采用固液反应装置,干燥氢气常用浓硫酸,因其具吸水性,氢气还原氧化铜固体需将导气管通入试管底部氧化铜的上方加热,故应选装置B、F、C;反应时会出现黑色固体变红色,试管口有水滴生成的现象;
(3)稀释浓硫酸时,根据稀释前后容质量不变计算所需浓硫酸的质量,再由密度求其体积量,即:100g×9.8%═浓硫酸质量×98%,浓硫酸质量═10g,由密度公式求得浓硫酸体积═5.4mL,稀释浓硫酸用到烧杯、玻璃棒、胶头滴管、量筒,故缺少仪器选②④⑤.
(4)
| 操作 | 简答 |
| ①将反应后的固体放入烧杯中,加入足量的稀硫酸,搅拌,使其充分反应. | 加足量稀硫酸的目的是:使氧化铜完全反应 |
| ②将操作①所得的混合物过滤. | 滤液中所含有的溶质是:CuSO4、H2SO4 |
| ③将操作②所得的滤渣洗涤、烘干,得到纯净的铜, |
(1)①烧杯、②漏斗;
(2)B、F、C;黑色固体变红色,试管口有水滴;
(3)5.4;②④⑤;
(4)
| 操作 | 简答 |
| ①将反应后的固体放入烧杯中,加入足量的稀硫酸,搅拌,使其充分反应. | 加足量稀硫酸的目的是:使氧化铜完全反应 |
| ②将操作①所得的混合物过滤. | 滤液中所含有的溶质是:CuSO4、H2SO4 |
| ③将操作②所得的滤渣洗涤、烘干,得到纯净的铜, |
点评:此题考查了常用仪器的识别与书写,氢气的实验室制法、干燥方法及其还原性,有关溶液的稀释计算及配制溶液的方法、所需仪器的熟悉了解,混合物的分离等知识,涉及知识面广,能很好的培养学生的知识掌握能力.

练习册系列答案
相关题目