题目内容
小韬买了一瓶钙片说明书某些地方模糊不清.于是她做实验探究:取2片钙片加入50g盐酸溶液,两者恰好完全反应(假设钙片中其他成分不与盐酸溶液反应),测得玻璃杯中剩余物质的总质量(m)与反应时间(t)的关系如图所示.
| XX钙片 主要成分:CaCO3 规格:每片2.0g 用量:一日一次,每次2片 含量:碳酸钙__g/片 可提供该元素__g/片 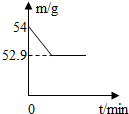 请你帮小韬计算 (1)反应后产生气体的质量 1.1 1.1 g.(2)所用盐酸溶液中溶质的质量分数. (3)请你通过计算,在标签的最后一行补充上相应内容: 含量:碳酸钙 1.25 1.25 g/片 可提供钙元素0.5 0.5 g/片<(2)、(3)两问写出计算过程>
分析:(1)根据反应前后质量减少的就是二氧化碳的质量进行解答; (2)根据二氧化碳的质量利用化学反应方程式求出白醋中溶质的质量进而求出所用白醋中溶质的质量分数即可; (3)根据二氧化碳的质量利用化学反应方程式求出碳酸钙的质量即可. 解答:解:(1)由图可知,反应后产生的二氧化碳气体的质量为54g-52.9g=1.1g; (2)设两片钙片所含碳酸钙的质量为x,所用盐酸中溶质的质量为y. CaCO3+2HCl═CaCl2+H2O+CO2↑ 100 73 44 x y 1.1g
解得:x=2.5g y=1.825g 所用盐酸溶液中溶质的质量分数为:
答:所用盐酸溶液中溶质的质量分数为3.65%; (3)所以每片钙片中碳酸钙的质量为:2.5g÷2=1.25g 可提供钙元素的质量为:1.25g×
故答案为:(1)1.1g; (2)3.65%; (3)1.25;0.5. 点评:利用质量守恒定律求出反应放出二氧化碳的质量,是进行后面计算的基础,体现出运用知识分析问题的能力. 
练习册系列答案
相关题目
|
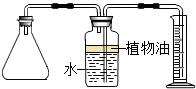 小孙买了一种“汽泡爽”的冲调饮料.
小孙买了一种“汽泡爽”的冲调饮料.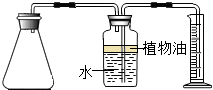 (2012?金山区一模)小明买了一种“汽泡爽”的冲调饮料.小明观察了饮料说明后,他借助化学实验的方法,探究“汽泡爽”产生气体的成分,以及加水温度对产生气体量的影响.
(2012?金山区一模)小明买了一种“汽泡爽”的冲调饮料.小明观察了饮料说明后,他借助化学实验的方法,探究“汽泡爽”产生气体的成分,以及加水温度对产生气体量的影响.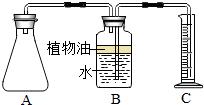 小孙买了一种“汽泡爽”的冲调饮料.
小孙买了一种“汽泡爽”的冲调饮料. 如图.请回答:
如图.请回答: