题目内容
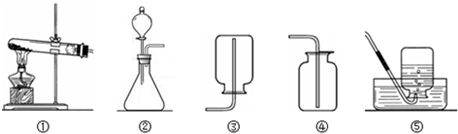
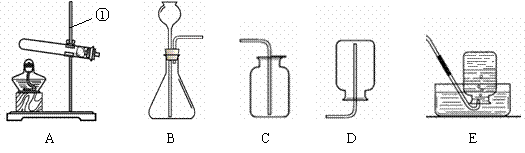
现有下列装置,回答问题:
(1)写出有标号仪器的名称:① ;
(2)检查B装置的气密性的方法是: ,向长颈漏斗中加适量的水,若观察到长颈漏斗末端出现稳定的水柱,则装置不漏气;
(3)实验室制取H2的反应化学方程式为 ,发生装置为 ;
(4)实验发现:用40%的硫酸制取H2效果最好。现欲配制30mL 40%(密度为1.30g·mL—1)的硫酸,需要98%(密度为1.84g·mL—1)的浓硫酸 mL(精确到小数点后一位),需要水 mL(精确到小数点后一位)。量取浓硫酸时,若仰视读数(其他操作均正确),则所配硫酸的质量分数 40%(填“>”或“=”或“<”),配制过程不需要的仪器是 ;
A.托盘天平 B.量筒 C.烧杯 D.玻璃棒 E.胶头滴管 F.铁架台
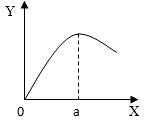
(5)实验室制取H2时,在硫酸溶液中滴入饱和CuSO4溶液会影响反应速率。右图是滴入饱和CuSO4溶液体积(X)与反应速率(Y)的关系图,请回答:
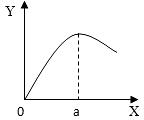
①滴入CuSO4溶液后,发生反应的化学方程式为 ;
②a点过后,反应速率降低的原因可能是 。
(1)铁架台 (2)堵住右侧导气管 (3)Zn + H2SO4 ="=" ZnSO4 + H2↑ (或
Zn+2HCl="ZnCl2+" H2↑) B (4)8.7 23.0(或23.1) > AF (共1分,全对得1分)
(5)①Zn + CuSO4 ="=" ZnSO4 + Cu ②生成的Cu覆盖在Zn表面,阻止反应进一步进行(或硫酸浓度变小,使反应速率降低)
【解析】
试题分析:(1)根据实验室常用仪器的名称回答,图中仪器①的名称是铁架台。
(2)根据气密性检查的原理分析,装置的气密性检查,是利用给装置加热,使其内部气压增大而实现的,而由于该装置有两个出口,故检查气密性时,应先堵住一个出口;如先用止水夹夹住橡皮管,然后往长颈漏斗中加入水至形成一段高于试管内液面的水柱,静置水柱高度不变,则装置气密性好。
(3)实验室常用锌粒和稀硫酸反应制取氢气,故反应的化学方程式为Zn+H2SO4=ZnSO4+H2↑,该反应是固液体在常温下的反应,故属于“固液不加热型”,故应选择B装置作为发生装置。
(4)用98%(密度为1.84g·mL—1)的浓硫酸配制40%(密度为1.30g·mL—1)的稀硫酸,需要加水,故溶剂的质量会变大,溶液的质量也会随之变大,但溶质的质量不变,据此列式解答。
设需要98%(密度为1.84g·mL—1)的浓硫酸xmL,则x×1.84g·mL—1×98%=30mL×1.30g·mL—1×40%,解得x=8.7mL;则需要水的体积=  =23mL。
=23mL。
量取浓硫酸时,若仰视读数(其他操作均正确),则量取的实际液体的量要大于读数,故所配硫酸的质量分数>40%;由于整个配制过程中不需要称量固体质量,故不需要托盘天平,配制过程中也不需要固定装置,故不需要铁架台,故选AF。
(5)①Zn与CuSO4溶液反应生成铜和硫酸亚铁,故反应的化学方程式为Zn+CuSO4=ZnSO4+Cu;
②由于反应生成的Cu覆盖在Zn的表面,阻止了Zn与硫酸的接触,从而阻止了反应的进一步进行;当然,随着反应的进行,硫酸的浓度会变小,反应速率自然会降低。
考点:常用仪器的名称和选用,装置气密性的检查,常用气体的发生装置和收集装置与选取方法,实验室制取氢气的反应原理,书写化学方程式,有关溶液的稀释的计算,一定溶质质量分数的溶液的配制,金属的化学性质
点评:化学是一门以实验为基础的学科,熟练掌握常见仪器的名称、实验的注意事项、气体的制取装置和收集装置的选择等,是解题的关键。

 名校课堂系列答案
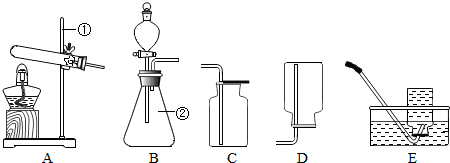
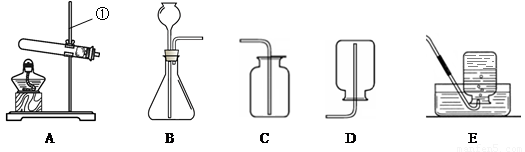
名校课堂系列答案现有下列装置,回答问题:
 |
(1)写出有标号仪器的名称:① ▲ ;
(2)检查B装置的气密性的方法是: ▲ ,向长颈漏斗中加适量的水,若观察到长颈漏斗末端出现稳定的水柱,则装置不漏气;
(3)实验室制取H2的反应化学方程式为 ▲ ,发生装置为 ▲ ;
(4)实验发现:用40%的硫酸制取H2效果最好。现欲配制30mL 40%(密度为1.30g·mL—1)的硫酸,需要98%(密度为1.84g·mL—1)的浓硫酸 ▲ mL(精确到小数点后一位),需要水 ▲ mL(精确到小数点后一位)。量取浓硫酸时,若仰视读数(其他操作均正确),则所配硫酸的质量分数 ▲ 40%(填“>”或“=”或“<”),配制过程不需要的仪器是 ▲ ;
A.托盘天平 B.量筒 C.烧杯 D.玻璃棒 E.胶头滴管 F.铁架台
(5)实验室制取H2时,在硫酸溶液中滴入饱和CuSO4溶液会影响反应速率。右图是滴入饱和CuSO4溶液体积(X)与反应速率(Y)的关系图,请回答:
①滴入CuSO4溶液后,发生反应的化学方程式为 ▲ ;
②a点过后,反应速率降低的原因可能是 ▲ 。