题目内容
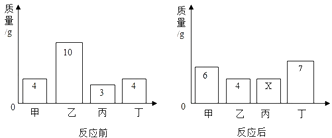
【题目】一定条件下,24g CH4和一定量的氧气恰好完全反应,生成 54g H2O、22g CO2和 28g X.则参加反应的氧气的质量为g,反应的化学方程式中 CO2和 H2O 的化学计量数之比为;若增加g O2 , 甲烷能燃烧充分.
【答案】80;1:6;16
【解析】解:(1)根据质量守恒定律,参加反应的氧气的质量为:54g+22g+28g﹣24g=80g;(2)化学方程式中 CO2和 H2O 的化学计量数之比为: ![]() =1:6;(3)设24g CH4完全燃烧所需氧气的质量为x
=1:6;(3)设24g CH4完全燃烧所需氧气的质量为x
CH4+ | 2O2 |
|
16 | 64 | |
24g | x |
![]()
x=96g
故需增加氧气的质量为:96g﹣80g=16g
故填:80;1:6;16
【考点精析】利用质量守恒定律及其应用对题目进行判断即可得到答案,需要熟知①质量守恒定律只适用于化学变化,不适用于物理变化;②不参加反应的物质质量及不是生成物的物质质量不能计入“总和”中;③要考虑空气中的物质是否参加反应或物质(如气体)有无遗漏.

练习册系列答案
相关题目