题目内容
【题目】某兴趣小组的同学为测定某石灰石中碳酸钙(假设:石灰石中的杂质不与盐酸反应)的质量分数,称取一定质量的石灰石置于烧杯中,用某浓度的稀盐酸100g,分5次加入,每次充分反应后,取出固体,经过滤、洗涤、干燥等操作后称重,各次稀盐酸用量和剩余固体质量记录如下:
实验次数 | 稀盐酸的用量(g) | 剩余固体的质量(g) |
① | 20 | 16.25 |
② | 40 | 12.50 |
③ | 60 | m |
④ | 80 | 5.00 |
⑤ | 100 | n |

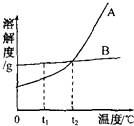
请细心观查表格和图象,回答下列问题:
(1)第______次石灰石中的碳酸钙与盐酸恰好反应完毕;
(2)表格中m= ______g,n=______g;
(3)计算该石灰石样品完全反应生成二氧化碳的质量为______.
【答案】 ④ 8.75 5.00 6.6g
【解析】主要考查了根据表格和图像去分析数据及根据化学方程式的计算。数据的分析是解题关键。
(1)因为从①②次反应数据可知,每次剩余固体减少的质量都是3.75g,每消耗20g盐酸时消耗的碳酸钙质量是3.75g,故m=12.5g-3.75g=8.75g,按照此反应的情况④中的固体是恰好完全反应;
(2)因为从①②次反应数据可知,每次剩余固体减少的质量都是3.75g,故m=12.5g-3.75g=8.75g,依据第四次反应恰好完成则可知n=5.0g;
(3)由图示可知,反应前石灰石的质量为20g,碳酸钙和盐酸充分反应后,剩余的固体物质的质量为5g,故碳酸钙的质量=20g-5g=15g,设生成二氧化碳的质量为x, CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
15g x
![]()
解之得:x=6.6g

练习册系列答案
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案
相关题目