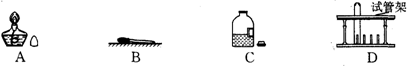
题目内容
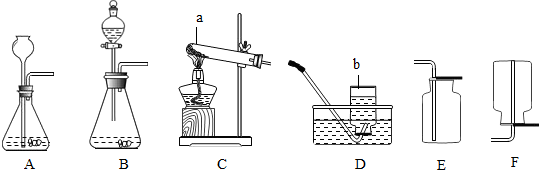
(4分)氨气(NH3)是一种无色、有刺激性气味的气体,密度小于空气,极易溶于水,它的水溶液称为氨水,显碱性。氨在化学工业中用途很广泛,例如制化肥、制纯碱等;近年来,氨还用于环境治理。(1)实验室收集氨气可采用的方法为 。
(2)氨气在一定条件下(高温、催化剂)与氧气反应生成一氧化氮和水,试写出该反应的化学方程式: 。
(3)在400℃左右,有催化剂存在的条件下,用氨气可将有毒气体NO2转化,该反应的化学方程式为8NH3+6NO2==7N2+12 A , 其中A的化学式为 。
(4)工业上,在细菌作用下用氨处理含甲醇的废水,使其变为无毒的N2和CO2,从而清除对环境的污染,有关的反应为:6 NH3 +5CH3OH +12 O2
 3 N2↑+5 CO2↑+19 H2O,上述反应前后N元素的化合价的变化情况为 (填“升高”“降低”“不变”)。
3 N2↑+5 CO2↑+19 H2O,上述反应前后N元素的化合价的变化情况为 (填“升高”“降低”“不变”)。
(4分)向下排空气法; 4NH3+5O2 == == 4NO+6H2O ; H2O; 升高 。解析:
== 4NO+6H2O ; H2O; 升高 。解析:
氨气密度小于空气所以要用向下排空气法;可以根据反应前后原子的个数和种类都不变即可查出A的化学式为H2O,NH3 中N元素的化合价为-3价,N2中N元素的化合价为0价,所以升高
 == 4NO+6H2O ; H2O; 升高 。解析:
== 4NO+6H2O ; H2O; 升高 。解析:氨气密度小于空气所以要用向下排空气法;可以根据反应前后原子的个数和种类都不变即可查出A的化学式为H2O,NH3 中N元素的化合价为-3价,N2中N元素的化合价为0价,所以升高

练习册系列答案
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案
相关题目