题目内容
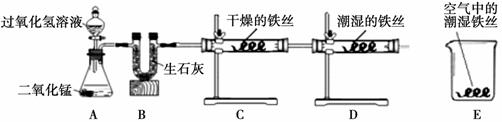
某校化学兴趣小组将一根光亮的细铁丝均分为三份,绕成相同的形状用下图所示装置对铁生锈的条件进行了探究。

请回答:
(1)A中反应的化学方程式为 ;
(2)B中生石灰的作用是除去氧气中的水蒸气,其反应的化学方程式为 ;
(3)4分钟后观察:C处铁丝依然光亮,D处铁丝表面灰暗,E中铁丝依然光亮。说明铁生锈主要与 、 有关。
(4)D、E处实验现象对比说明:决定铁生锈快慢的一个重要因素是 。
【答案】
(1)2H2O2二氧化锰2H2O+O2↑ (2)CaO+H2O= Ca(OH)2
(3)氧气 水(或O2 H2O) (4)氧气的浓度
【解析】
试题分析:(1)在A中的二氧化锰与过氧化氢溶液反应,生成水和氧气,故反应的方程式是2H2O2二氧化锰2H2O+O2↑。
(2)B中生石灰能除去氧气中的水蒸气,是因为生石灰能与水反应生成熟石灰,故其反应的化学方程式为CaO+H2O= Ca(OH)2。
(3)根据C、D、E中的实验现象分析,C处铁丝依然光亮(缺水),D处铁丝表面灰暗(有水和氧气),E中铁丝依然光亮(氧气量较少),故能说明铁生锈主要与水和氧气有关。
(4)D、E处实验现象对比说明:决定铁生锈快慢的一个重要因素是氧气的浓度,氧气浓度越大,铁生锈速度越快。
考点:金属锈蚀的条件及其防护,实验室制取氧气的反应原理,生石灰的性质与用途,书写化学方程式
点评:本题难度不大,熟练掌握相关物质的性质,是解答本题的关键,故要求学生在平时的学习中要注意相关知识的积累。

练习册系列答案
相关题目
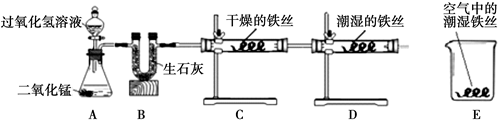
 锈主要与 ▲ 、 ▲ 有关。
锈主要与 ▲ 、 ▲ 有关。