题目内容
氯化钠是日常生活的必需品,也是重要的化工原料.
(1)粗盐除含NaCl外,还含有少量MgCl2、CaCl2、Na2SO4以及泥沙等杂质.以下是粗盐提纯的操作流程.
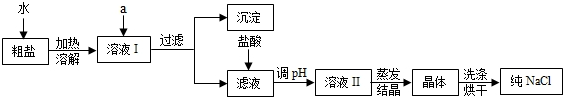
提供的试剂:Na2CO3溶液、K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、饱和NaCl溶液.
①欲除去溶液I中的MgCl2、CaCl2、Na2SO4,从提供的试剂中选出a所代表的试剂,按滴加顺序依次为:过量的NaOH溶液、______、______;②在滤液中加盐酸的作用是______;
(2)用提纯的NaCl配制200g0.9%的生理盐水,需要NaCl的质量为______g.
①配制该溶液时所需要的玻璃仪器有______
②如果配制后溶液溶质的质量分数低于0.9%,你认为可能的原因是______.(任写一个)
解:(1)①要除去溶液I中的MgCl2、CaCl2、Na2SO4,所选试剂分别是氢氧化钠溶液,碳酸钠溶液和氯化钡溶液,根据题意要求,为了更好的把杂质除去,不带入新的杂质,所加溶液的顺序是氢氧化钠溶液,BaCl2溶液,Na2CO3溶液.②由于过滤后的滤液中含有氢氧化钠和碳酸钠,所以要加入适量的盐酸,目的是除去过量的NaOH和Na2CO3
(2)氯化钠溶质的质量=溶液的质量×溶质的质量分数=200g×0.9%=1.8g
①配制溶液需要的玻璃仪器有:烧杯、玻璃棒、量筒、胶头滴管
②如果配制后溶液溶质的质量分数低于0.9%,可能的原因是:称量NaCl的操作错误,如左盘放了纸片,右盘未放纸片;用量筒量取水时错误,如取水时仰视读数、烧杯中有水等;氯化钠中混有杂质.
故答案为:(1)①BaCl2溶液,Na2CO3溶液;②除去过量的NaOH和Na2CO3;
(2)1.8g;①烧杯、玻璃棒、量筒、胶头滴管;②称量NaCl的操作错误,如左盘放了纸片,右盘未放纸片.
分析:(1))①欲除去溶液I中的MgCl2、CaCl2、Na2SO4,则用氢氧化镁除掉氯化镁,用氯化钡除掉硫酸钠,用碳酸钠除掉氯化钙与多余的氯化钡;
②在滤液中加盐酸的作用,应考虑除去NaOH、Na2CO3溶液;
(2)根据溶质质量分数的计算公式和配制溶液的方法回答,配制后溶液溶质的质量分数低于0.9%,要从造成溶质质量少或溶剂质量多的原因考虑.
点评:本题考查了物质的除杂和有关溶液的计算和配制,难度比较大,特别的除去食盐中的多种杂质,要根据除杂的原理深入思考,按照最优化的顺序添加除杂剂.
(2)氯化钠溶质的质量=溶液的质量×溶质的质量分数=200g×0.9%=1.8g
①配制溶液需要的玻璃仪器有:烧杯、玻璃棒、量筒、胶头滴管
②如果配制后溶液溶质的质量分数低于0.9%,可能的原因是:称量NaCl的操作错误,如左盘放了纸片,右盘未放纸片;用量筒量取水时错误,如取水时仰视读数、烧杯中有水等;氯化钠中混有杂质.
故答案为:(1)①BaCl2溶液,Na2CO3溶液;②除去过量的NaOH和Na2CO3;
(2)1.8g;①烧杯、玻璃棒、量筒、胶头滴管;②称量NaCl的操作错误,如左盘放了纸片,右盘未放纸片.
分析:(1))①欲除去溶液I中的MgCl2、CaCl2、Na2SO4,则用氢氧化镁除掉氯化镁,用氯化钡除掉硫酸钠,用碳酸钠除掉氯化钙与多余的氯化钡;
②在滤液中加盐酸的作用,应考虑除去NaOH、Na2CO3溶液;
(2)根据溶质质量分数的计算公式和配制溶液的方法回答,配制后溶液溶质的质量分数低于0.9%,要从造成溶质质量少或溶剂质量多的原因考虑.
点评:本题考查了物质的除杂和有关溶液的计算和配制,难度比较大,特别的除去食盐中的多种杂质,要根据除杂的原理深入思考,按照最优化的顺序添加除杂剂.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目




