题目内容
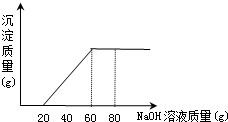
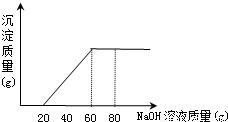
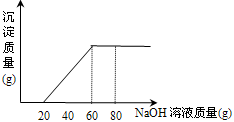
今有50 g盐酸与氯化镁的混合溶液,向其中滴加溶质质量分数为20%的氢氧化钠溶液,所加氢氧化钠溶液质量与生成沉淀的质量关系如图所示,求(1)原盐酸中氯化氢的质量分数.(2)生成沉淀的最大质量.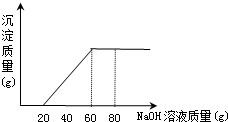
分析:(1)氢氧化钠滴加时是先与盐酸反应,从图示可以看出是消耗了20g氢氧化钠时恰好把酸中和.
(2)由图示可知氯化镁与氢氧化钠反应时共消耗氢氧化钠的质量是40g.
(2)由图示可知氯化镁与氢氧化钠反应时共消耗氢氧化钠的质量是40g.
解答:解:(1)完全中和盐酸需氢氧化钠溶液的质量是20g,共有氢氧化钠20g×20%=4g
设溶液中的盐酸质量是X
NaOH+HCl=NaCl+H2O
40 36.5
4g x
=
x=3.65g
×100%=7.3%
(2)设反应中生成的氢氧化镁沉淀的质量为y,
2NaOH+MgCl2=2NaCl+Mg(OH)2↓
80 58
40g×20% y
=
y=5.8g
答:(1)原盐酸中氯化氢的质量分数是7.3%.(2)生成沉淀的最大质量是5.8g.
设溶液中的盐酸质量是X
NaOH+HCl=NaCl+H2O
40 36.5
4g x
| 40 |
| 4g |
| 36.5 |
| x |
x=3.65g
| 3.65g |
| 50g |
(2)设反应中生成的氢氧化镁沉淀的质量为y,
2NaOH+MgCl2=2NaCl+Mg(OH)2↓
80 58
40g×20% y
| 80 |
| 58 |
| 40g×20% |
| y |
y=5.8g
答:(1)原盐酸中氯化氢的质量分数是7.3%.(2)生成沉淀的最大质量是5.8g.
点评:题主要考查学生利用化学方程式和溶质质量分数公式进行计算的能力,学生要有较强的识图能力和数据分析能力,才能正确解答.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目