题目内容
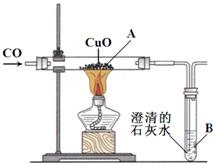 下图为一氧化碳还原氧化铜的装置图:
下图为一氧化碳还原氧化铜的装置图:(1)图中A处的实验现象是
黑色固体逐渐变为光亮的红色
黑色固体逐渐变为光亮的红色
,B处的实验现象是澄清石灰水变浑浊
澄清石灰水变浑浊
.(2)该装置存在的主要问题是,
从导管中排出的尾气中含有CO会污染空气
从导管中排出的尾气中含有CO会污染空气
,改进的具体措施是须将尾气点燃或将尾气集中收集
须将尾气点燃或将尾气集中收集
.(3)何洁同学在研究其反应后残留物的组成成分.请你参与此项研究,并将你的猜想、实验内容、现象及结论填入表中.
| 猜想 | 实验内容 | 观察的现象 | 解释或结论 |
分析:(1)根据一氧化碳还原氧化铜的反应原理分析即可;
(2)根据一氧化碳还原氧化铜的操作注意事项分析即可;
(3)根据残留物的可能成分及其化学性质分析即可.
(2)根据一氧化碳还原氧化铜的操作注意事项分析即可;
(3)根据残留物的可能成分及其化学性质分析即可.
解答:(1)因为氧化铜是黑色固体,被一氧化碳还原成铜,而铜是红色固体,同时生成二氧化碳气体,二氧化碳能使澄清石灰水变混浊,故答案为:
A处:黑色固体逐渐变为光亮的红色;B处:澄清石灰水变浑浊
(2)因为一氧化碳有毒,所以不能直接排到空气中,需进行尾气处理,可将其点燃转化为二氧化碳再排到空气中,
故答案为:从导管中排出的尾气中含有CO会污染空气;须将尾气点燃或将尾气集中收集;
(3)铜不会与稀硫酸或稀盐酸反应,氧化铜会与稀硫酸或稀盐酸反应生成Cu2+,使溶液显蓝色,故答案为:

A处:黑色固体逐渐变为光亮的红色;B处:澄清石灰水变浑浊
(2)因为一氧化碳有毒,所以不能直接排到空气中,需进行尾气处理,可将其点燃转化为二氧化碳再排到空气中,
故答案为:从导管中排出的尾气中含有CO会污染空气;须将尾气点燃或将尾气集中收集;
(3)铜不会与稀硫酸或稀盐酸反应,氧化铜会与稀硫酸或稀盐酸反应生成Cu2+,使溶液显蓝色,故答案为:

点评:此实验还应注意:实验开始时先通一氧化碳再加热.

练习册系列答案
相关题目
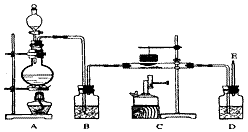
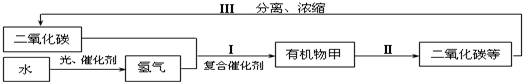
(8分)在研究氧气的性质时,同学们发现含氧元素的质量可以相互转化,如“氧化物甲 氧气
氧气 氧化物甲”的转化,反应I的化学方程式为 。
氧化物甲”的转化,反应I的化学方程式为 。
【提出问题】铁丝能在氧气中燃烧,观察到火星四射、剧烈燃烧 。能不能将燃烧产物四氧化三铁再转化为铁单质呢?
【查阅资料】(1)Fe3O4的分解温度为1538 oC
(2)CO具有还原性,能将某些金属氧化物还原为金属单质
(3)酒精灯外焰温度约700 oC,酒精喷灯火焰温度约1000 oC
(4)铁丝为银白色,铁粉为黑色
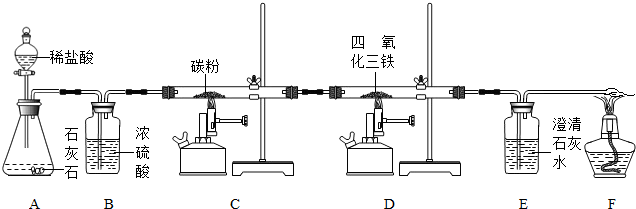
【设计实验】同学们设计了如下图所示的实验装置,对CO能不能将四氧化三铁转化为铁进行探究。结合图示回答问题。
(1)B装置中浓硫酸具有吸水性,能除去二氧化碳中的水蒸气,浓硫酸吸水过程会 (填“吸热”或“放热”)。
(2)C装置可将二氧化碳转化为一氧化碳,反应的化学方程式为 。
(3)F处点燃酒精的目的是 。
(4)依据现象得出结论,该设计中观察到以下现象,其中可以说明四氧化三铁与一氧化碳发生反应的现象是 (填字母序号)。
| A.澄清石灰水变浑浊 | B.反应前后D中质量减轻 |
| C.F导管口有蓝色火焰 | D.加热时,四氧化三铁变红 |
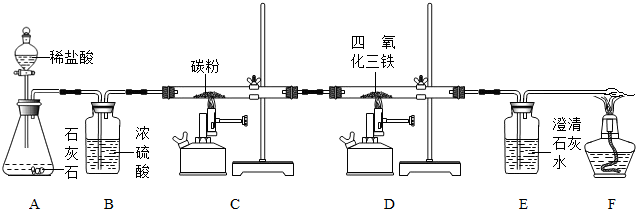
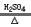 CO↑+H2O。下图是制备一氧化碳,一氧化碳还原三氧化二铁,并检验反应结束时的产物的实验装置。
CO↑+H2O。下图是制备一氧化碳,一氧化碳还原三氧化二铁,并检验反应结束时的产物的实验装置。