题目内容
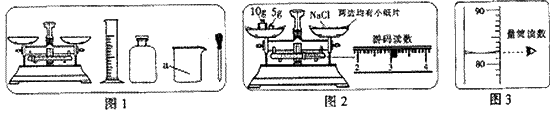
化学实验能使我们获得许多重要的化学知识和学习的快乐.下面是某兴趣小组利用下图所示仪器,“配制一定质量分数的氯化钠溶液”的实验.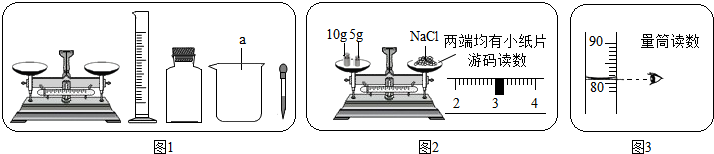
(1)欲配制100g溶质质量分数为15%的氯化钠溶液,完成此实验正确的操作顺序是(填序号)
①溶解
②把配好的溶液装入试剂瓶③称量④计算⑤量取
(2)按配制溶液的实验要求,图1中还缺少的玻璃仪器是(填名称)
(3)实验操作称固体的质量如图2所示,请你分析称固体氯化钠的操作中错误是
(4)实验操作所取蒸馏水的体积如图3所示,则该实验小组实际配制的氯化钠溶液中溶质的质量分数为(水的密度约为1g/cm3)
分析:(1)使用固体氯化钠配制溶液,需要经过计算-称量-溶解的过程,据此对操作进行排序;
(2)根据配制溶液的操作过程确定所需要的仪器,与图进行对比,找出图中所缺仪器;
(3)分析图示称取固体氯化钠的操作,指出操作中的错误,并根据当前操作判断所称取氯化钠的质量;
(4)根据称取氯化钠质量和量取水的体积,计算所配制溶液的质量分数,并与推断所欲配制溶液的质量分数进行比较.
(2)根据配制溶液的操作过程确定所需要的仪器,与图进行对比,找出图中所缺仪器;
(3)分析图示称取固体氯化钠的操作,指出操作中的错误,并根据当前操作判断所称取氯化钠的质量;
(4)根据称取氯化钠质量和量取水的体积,计算所配制溶液的质量分数,并与推断所欲配制溶液的质量分数进行比较.
解答:解:(1)使用固体氯化钠配制氯化钠溶液的配制步骤为计算-称量-溶解,因此,正确的操作顺序应为④计算③称量⑤量取①溶解②把配好的溶液装入试剂瓶;
(2)配制溶液时进行溶解操作需要玻璃棒搅拌,图中没有该仪器;
(3)称取固体氯化钠时,应遵循“左物右码”的使用方法进取称取,而图示操作氯化钠与砝码放反位置,致使氯化钠的质量=砝码质量-游码质量=10g+5g-3g=12g;
(4)图示所量取水的体积为82mL,因此所配制溶液的质量分数=
×100%≈12.8%;根据天平使用情况可推测原计划称取氯化钠质量=10g+5g+3g=18g,根据量取水的操作原计划量取水82mL,因此原计划配制溶液的质量分数=
×100%=18%,而由于称取氯化钠小于18g,而使所配制溶液质量分数小于原计划配制的溶液;
故答案为:
(1)④③⑤①②;
(2)玻璃棒;
(3)称量时砝码与氯化钠的位置放反了;12;
(4)12.8%;比原计划配制的氯化钠溶液中溶质的质量分数减小了,因为氯化钠质量少称了3g.(其他答案合理给分)
(2)配制溶液时进行溶解操作需要玻璃棒搅拌,图中没有该仪器;
(3)称取固体氯化钠时,应遵循“左物右码”的使用方法进取称取,而图示操作氯化钠与砝码放反位置,致使氯化钠的质量=砝码质量-游码质量=10g+5g-3g=12g;
(4)图示所量取水的体积为82mL,因此所配制溶液的质量分数=
| 12g |
| 12g+82g |
| 18g |
| 18g+82g |
故答案为:
(1)④③⑤①②;
(2)玻璃棒;
(3)称量时砝码与氯化钠的位置放反了;12;
(4)12.8%;比原计划配制的氯化钠溶液中溶质的质量分数减小了,因为氯化钠质量少称了3g.(其他答案合理给分)
点评:抓住导致配制溶液时所出现误差的根本原因:溶质量或多或少、溶剂量或多或少,分析操作对溶质、溶剂量所造成的影响,使配制溶液出现误差类问题可以轻松解决.

练习册系列答案
 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案
相关题目

 :A.实验前要先除去铁丝和银丝表面的氧化物,操作方法是
:A.实验前要先除去铁丝和银丝表面的氧化物,操作方法是