题目内容
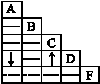
镁是一种用途很广的金属材料,目前世界上60%的镁是从海水中提取的,主要步骤是从海水中得到金属镁。下图是从海水中提取镁的简单流程。

(1)为了使 MgCl2转化为沉淀,试剂A可以用______,
加入试剂A过量的目的是 ,验证MgCl2已完全沉淀的方法是____________。
(2)加入试剂A后,能分离得到沉淀的操作名称是____ ____。
(3)试剂C可选用____ __。
(4)无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,写出该反应的化学方程式: ___ _ _。
(5)海水本身就是含有MgCl2的溶液,它与通过步骤①、②得到的MgCl2溶液有何不同: 。

(1)为了使 MgCl2转化为沉淀,试剂A可以用______,
加入试剂A过量的目的是 ,验证MgCl2已完全沉淀的方法是____________。
(2)加入试剂A后,能分离得到沉淀的操作名称是____ ____。
(3)试剂C可选用____ __。
(4)无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,写出该反应的化学方程式: ___ _ _。
(5)海水本身就是含有MgCl2的溶液,它与通过步骤①、②得到的MgCl2溶液有何不同: 。
(1)NaOH,为了使 MgCl2全部转化为Mg(OH)2沉淀,加入酚酞试液、如果溶液变蓝证明溶液显碱性。或者取上层清液滴加氢氧化钠溶液没有产生白色浑浊,证明镁离子已经沉淀完全。 通电
(2)过滤 (3)盐酸 (4)MgCl2 (熔融) == Mg + Cl2↑
(5)步骤①得到的溶液没有镁离子,步骤②得到是纯净的氯化镁溶液
(2)过滤 (3)盐酸 (4)MgCl2 (熔融) == Mg + Cl2↑
(5)步骤①得到的溶液没有镁离子,步骤②得到是纯净的氯化镁溶液
先加氢氧化钠使镁离子沉淀,要是镁离子全部转化加的氢氧化钠必须过量。镁离子富聚后再加盐酸,溶解沉淀得到MgCl2溶液,干燥后再电解得到单质镁。其实不一定要加强碱也可以加碳酸钠溶液,从海水中提取镁是对海水资源的开发利用。

练习册系列答案
相关题目
某同学把自家厨房中一种白色粉末拿到学校实验室进行实验,实验过程与现象如下:

对此粉末的成分判断正确的是

对此粉末的成分判断正确的是
| A.该粉末一定是碳酸钠 | B.该粉末一定是碳酸氢钠 |
| C.该粉末一定是氯化钠 | D.该粉末可能是碳酸钠或碳酸氢钠 |