题目内容
在探究某物质的组成时,某实验小组的同学将3g该物质放在氧气中充分燃烧后,测得生成物有8.8g二氧化碳和5.4g水,你认为该物质的组成为
| A.一定含有碳、氢、氧三种元素 | B.一定含有碳、氢元素,可能含有氧元素 |
| C.氢元素的质量分数为20% | D.碳元素与氢元素质量比为1:4 |
C
解析试题分析:8.8g二氧化碳中含有C的质量=8.8× =2.4g,5.4g水中含有H的质量=5.4×
=2.4g,5.4g水中含有H的质量=5.4×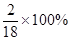 =0.6g,C、H的质量之和=2.4+0.6=3g,C、H的质量比为2.4:0.6=4:1;由质量守恒定律可知,该C、H元素来自燃烧的物质,故该物质中含有C、H,不含O;氢元素的质量分数为
=0.6g,C、H的质量之和=2.4+0.6=3g,C、H的质量比为2.4:0.6=4:1;由质量守恒定律可知,该C、H元素来自燃烧的物质,故该物质中含有C、H,不含O;氢元素的质量分数为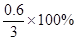 =20%。选C。
=20%。选C。
考点:质量守恒定律;元素的质量比;元素的质量分数;物质的组成。
点评:解答本题的关键是要根据质量守恒定律来确定该物质中是否含有O元素。

练习册系列答案
 春雨教育同步作文系列答案
春雨教育同步作文系列答案
相关题目
在探究某物质的组成时,某实验小组的同学将3g该物质放在氧气中充分燃烧后,测得生成物有8.8g二氧化碳和5.4g水,你认为该物质的组成为( )
| A、一定含有碳、氢、氧三种元素 | B、一定含有碳、氢元素,可能含有氧元素 | C、氢元素的质量分数为20% | D、碳元素与氢元素质量比为1:4 |