题目内容
下列仪器能加热,但加热时需要垫上石棉网的是( )
| A.烧杯 | B.量筒 | C.试管 | D.蒸发皿 |
A、烧杯底面积较大,加热时易受热不均而炸裂,故加热时需要垫上石棉网,所以正确.
B、量筒是量度液体体积的仪器,不能加热,所以错误.
C、试管底面积较小,只要加热前充分预热,就不会因受热不均而炸裂,故可直接加热,所以错误.
D、蒸发皿是瓷制的,导热性好,受热均匀,加热时不需要垫上石棉网,所以错误.
故选A.

练习册系列答案
 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案
相关题目
 22、气体的制备是化学实验基本技能之一.现利用下列仪器进行实验,请回答下列问题.
22、气体的制备是化学实验基本技能之一.现利用下列仪器进行实验,请回答下列问题.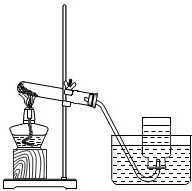 探究性实验是验证化学理论的一种主要方式,也展示了化学的无穷魅力.
探究性实验是验证化学理论的一种主要方式,也展示了化学的无穷魅力.
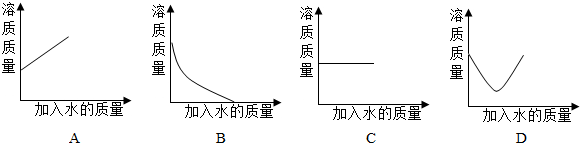
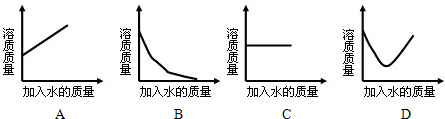
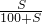 ×100%;
×100%; ×100%,若要使其溶质质量分数变为原来的
×100%,若要使其溶质质量分数变为原来的 倍,需加水________克.
倍,需加水________克.