题目内容
海水中的化学(1)人们从海水中可以获得很多有用的物质.如①淡水、②食盐、③镁、④纯碱等.获取这几种物质主要通过物理变化的是 ;需要发生化学变化的是 (填编号).
(2)海水中含有较多的硫酸钠.硫酸钠是制造纸浆、燃料稀释剂、医药用品等的重要原料.某硫酸钠粗品中含有少量的硫酸钙、硫酸镁,实验室进行提纯的流程如下:
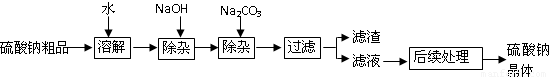
回答下列问题:
①用氢氧化钠和碳酸钠除杂时,反应的化学方程式分别为 、 .
②氢氧化钠和碳酸钠如果添加过量了,可在滤液中加入适量 溶液除去.
③“后续处理”的主要操作时蒸发,为了获得纯净的硫酸钠,应蒸发至 (填序号).
A.完全蒸干时停止加热
B.快干时停止加热,利用余热蒸干
C.有大量固体析出时停止加热,过滤弃去剩余的少量溶液
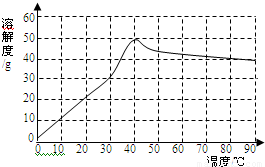
④已知硫酸钠的溶解度随温度变化的曲线如右图所示.40℃时,硫酸钠的溶解度为 g.将该饱和溶液升高温度至90℃,观察到的现象是 .
【答案】分析:(1)由海水的成分和物理变化和化学变化的特征分析判断即可.
(2)①本题给出了除去杂质应选用的试剂,由复分解反应发生的条件写出化学方程式即可;
②如果氢氧化钠和碳酸钠过量,可加入适量的稀硫酸,稀硫酸和氢氧化钠反应生成硫酸钠和水,稀硫酸和碳酸钠反应生成硫酸钠、水和二氧化碳;
③在蒸发过程中,不同于常规的蒸发操作,溶液中含有NaCl,需注意先加热后过滤;
④因为40℃时,硫酸钠的溶解度是50克,故100克水中溶解50克硫酸钠恰好饱和;当由40℃升高到90℃时,硫酸钠的溶解度减小,故有硫酸钠固体析出.
解答:解:(1)海水中含有食盐、水等物质,故获取淡水、食盐的过程中没有新物质生成,属于物理变化;海水中含有不含镁、纯碱等物质,故从海水中获取镁、纯碱等的过程中有新物质生成,属于化学变化.
(2):①由复分解反应发生的条件,氢氧化钠和硫酸镁反应生成氢氧化镁沉淀和硫酸钠,碳酸钠和硫酸钙反应生成碳酸钙沉淀和硫酸钠.反应的化学方程式为:2NaOH+MgSO4=Mg(OH)2↓+Na2SO4; Na2CO3+CaSO4═CaCO3↓+2Na2SO4
②硫酸和氢氧化钠反应生成硫酸钠和水,没有带入新杂质,碳酸钠和稀硫酸反应生成硫酸钠、水和二氧化碳,二氧化碳以气体形式逸出,不带入任何其它杂质.故除去过量的氢氧化钠和碳酸钠时,可以用稀硫酸.
③被加热的滤液中含有一定量的NaCl,故蒸发操作无法得到纯净的硫酸钠晶体,应加热使大部分硫酸钠晶体析出,而此时溶液中的溶质主要为氯化钠,然后过滤除去滤液,从而的较纯净的硫酸钠晶体.
④根据溶解度的定义以及溶解度受温度影响的关系可知.100克蒸馏水中溶解50克硫酸钠恰好饱和.由硫酸钠的溶解的曲线可知,在0℃到40℃之间,硫酸钠的溶解度随温度的升高而增大,在40℃到90℃时,硫酸钠的溶解度随温度的升高而减小.饱和的硫酸钠溶液由40℃升高到90℃时,溶解度减小,故有硫酸钠固体析出.
故答案为:
(1)①②;③④;
(2)①2NaOH+MgSO4=Mg(OH)2↓+Na2SO4 CaSO4+Na2CO3=CaCO3↓+Na2SO4 ②硫酸;③C;④50,有晶体析出.
点评:本题主要考查了选择试剂、化学方程式的书写、蒸发操作以及对固体溶解度曲线的意义,以此培养学生的理解能力、培养学生分析问题、解决问题的能力.
(2)①本题给出了除去杂质应选用的试剂,由复分解反应发生的条件写出化学方程式即可;
②如果氢氧化钠和碳酸钠过量,可加入适量的稀硫酸,稀硫酸和氢氧化钠反应生成硫酸钠和水,稀硫酸和碳酸钠反应生成硫酸钠、水和二氧化碳;
③在蒸发过程中,不同于常规的蒸发操作,溶液中含有NaCl,需注意先加热后过滤;
④因为40℃时,硫酸钠的溶解度是50克,故100克水中溶解50克硫酸钠恰好饱和;当由40℃升高到90℃时,硫酸钠的溶解度减小,故有硫酸钠固体析出.
解答:解:(1)海水中含有食盐、水等物质,故获取淡水、食盐的过程中没有新物质生成,属于物理变化;海水中含有不含镁、纯碱等物质,故从海水中获取镁、纯碱等的过程中有新物质生成,属于化学变化.
(2):①由复分解反应发生的条件,氢氧化钠和硫酸镁反应生成氢氧化镁沉淀和硫酸钠,碳酸钠和硫酸钙反应生成碳酸钙沉淀和硫酸钠.反应的化学方程式为:2NaOH+MgSO4=Mg(OH)2↓+Na2SO4; Na2CO3+CaSO4═CaCO3↓+2Na2SO4
②硫酸和氢氧化钠反应生成硫酸钠和水,没有带入新杂质,碳酸钠和稀硫酸反应生成硫酸钠、水和二氧化碳,二氧化碳以气体形式逸出,不带入任何其它杂质.故除去过量的氢氧化钠和碳酸钠时,可以用稀硫酸.
③被加热的滤液中含有一定量的NaCl,故蒸发操作无法得到纯净的硫酸钠晶体,应加热使大部分硫酸钠晶体析出,而此时溶液中的溶质主要为氯化钠,然后过滤除去滤液,从而的较纯净的硫酸钠晶体.
④根据溶解度的定义以及溶解度受温度影响的关系可知.100克蒸馏水中溶解50克硫酸钠恰好饱和.由硫酸钠的溶解的曲线可知,在0℃到40℃之间,硫酸钠的溶解度随温度的升高而增大,在40℃到90℃时,硫酸钠的溶解度随温度的升高而减小.饱和的硫酸钠溶液由40℃升高到90℃时,溶解度减小,故有硫酸钠固体析出.
故答案为:
(1)①②;③④;
(2)①2NaOH+MgSO4=Mg(OH)2↓+Na2SO4 CaSO4+Na2CO3=CaCO3↓+Na2SO4 ②硫酸;③C;④50,有晶体析出.
点评:本题主要考查了选择试剂、化学方程式的书写、蒸发操作以及对固体溶解度曲线的意义,以此培养学生的理解能力、培养学生分析问题、解决问题的能力.

练习册系列答案
相关题目
 (1)请用适合的化学符号填空:
(1)请用适合的化学符号填空: