题目内容
某化合物16克,在氧气中完全燃烧,生成44克二氧化碳和36克水,通过计算求该化合物的化学式 .
【答案】分析:根据质量守恒定律可知:生成二氧化碳中碳元素的质量等于该化合物中碳元素的质量;生成的水中氢元素的质量等于该化合物中氢元素的质量;其余则为氧元素的质量.根据该化合物的元素质量比就可以确定其的化学式.
解答:解:由题意可知,该物质中含碳元素为:44g×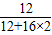 ×100%=12g;氢元素的质量为:36g×
×100%=12g;氢元素的质量为:36g×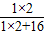 ×100%=4g;则所含氧元素的质量为16g-12g-4g=0g.即该化合物是由碳元素和氢元素组成的.
×100%=4g;则所含氧元素的质量为16g-12g-4g=0g.即该化合物是由碳元素和氢元素组成的.
设该化合物的化学式为CX HY
12X:Y=12:4;
X:Y=1:4
即该化合物的化学式为:CH4.
点评:物质在氧气中完全燃烧,产物只有二氧化碳和水.根据化学反应前后元素的种类和质量都不变,则生成的二氧化碳中碳元素的质量就是物质中碳元素的质量;生成的水中氢元素的质量就是物质中氢元素的质量.若碳元素与氢元素的质量和等于物质质量,则物质中不含氧元素;若小于物质质量,则物质中含有氧元素.
解答:解:由题意可知,该物质中含碳元素为:44g×
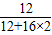 ×100%=12g;氢元素的质量为:36g×
×100%=12g;氢元素的质量为:36g×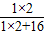 ×100%=4g;则所含氧元素的质量为16g-12g-4g=0g.即该化合物是由碳元素和氢元素组成的.
×100%=4g;则所含氧元素的质量为16g-12g-4g=0g.即该化合物是由碳元素和氢元素组成的.设该化合物的化学式为CX HY
12X:Y=12:4;
X:Y=1:4
即该化合物的化学式为:CH4.
点评:物质在氧气中完全燃烧,产物只有二氧化碳和水.根据化学反应前后元素的种类和质量都不变,则生成的二氧化碳中碳元素的质量就是物质中碳元素的质量;生成的水中氢元素的质量就是物质中氢元素的质量.若碳元素与氢元素的质量和等于物质质量,则物质中不含氧元素;若小于物质质量,则物质中含有氧元素.

练习册系列答案
相关题目