题目内容
氯化钠是一种重要的化工原料。电解氯化钠溶液可制得氯气、氢氧化钠等物质,反应的化学方程式为2NaCl+2H2O Cl2↑+H2↑+2NaOH。现取一定质量的氯化钠溶液进行电解,当氯化钠恰好完全反应时,得到51.2g溶液,生成氯气的质量与时间的关系如下图所示。请计算:
Cl2↑+H2↑+2NaOH。现取一定质量的氯化钠溶液进行电解,当氯化钠恰好完全反应时,得到51.2g溶液,生成氯气的质量与时间的关系如下图所示。请计算:
 Cl2↑+H2↑+2NaOH。现取一定质量的氯化钠溶液进行电解,当氯化钠恰好完全反应时,得到51.2g溶液,生成氯气的质量与时间的关系如下图所示。请计算:
Cl2↑+H2↑+2NaOH。现取一定质量的氯化钠溶液进行电解,当氯化钠恰好完全反应时,得到51.2g溶液,生成氯气的质量与时间的关系如下图所示。请计算: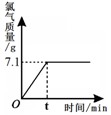
(1)氯化钠完全反应时,溶液中剩余水的质量。
(2)原氯化钠溶液中溶质的质量分数。
(3)若把这些氯化钠溶液稀释成溶质的质量分数为0.9%的生理盐水,需要加水的质量。
(2)原氯化钠溶液中溶质的质量分数。
(3)若把这些氯化钠溶液稀释成溶质的质量分数为0.9%的生理盐水,需要加水的质量。
解:(1)设消耗氯化钠的质量为x,生成氢氧化钠的质量为y,生成氢气的质量为z
2NaCl+2H2O Cl2↑+H2↑+2NaOH
Cl2↑+H2↑+2NaOH
2×58.5 71 2 2×40
x 7.1g z y
得方程(2×58.5):71=x:7.1g
71:(2×40)=7.1g:y
71:2=7.1g:z
解得x=11.7g;y=8g;z=0.2g
∴剩余水的质量:51.2g-8g=43.2g
(2)氯化钠溶液质量为:51.2g+7.1g+0.2g=58.5g
氯化钠溶液中溶质的质量分数为:
(3)设稀释后生理盐水的质量为a。58.5g×20%=a×0.9%
a=1300g
需要加水的质量为:1300g-58.5g=1241.5g
答:(1)氯化钠完全反应时,溶液中剩余水的质量为43.2g。
(2)原氯化钠溶液中溶质的质量分数为20%。
(3)若把这些氯化钠溶液稀释成0.9%的生理盐水,需要加水的质量为1241.5g。
(其它合理解法同样给分)
2NaCl+2H2O
 Cl2↑+H2↑+2NaOH
Cl2↑+H2↑+2NaOH2×58.5 71 2 2×40
x 7.1g z y
得方程(2×58.5):71=x:7.1g
71:(2×40)=7.1g:y
71:2=7.1g:z
解得x=11.7g;y=8g;z=0.2g
∴剩余水的质量:51.2g-8g=43.2g
(2)氯化钠溶液质量为:51.2g+7.1g+0.2g=58.5g
氯化钠溶液中溶质的质量分数为:

(3)设稀释后生理盐水的质量为a。58.5g×20%=a×0.9%
a=1300g
需要加水的质量为:1300g-58.5g=1241.5g
答:(1)氯化钠完全反应时,溶液中剩余水的质量为43.2g。
(2)原氯化钠溶液中溶质的质量分数为20%。
(3)若把这些氯化钠溶液稀释成0.9%的生理盐水,需要加水的质量为1241.5g。
(其它合理解法同样给分)

练习册系列答案
相关题目
 (2013?朝阳区一模)钠元素对人类生命和生活具有重要意义.
(2013?朝阳区一模)钠元素对人类生命和生活具有重要意义.
 钠元素对人类生命和生活具有重要意义.
钠元素对人类生命和生活具有重要意义.
