题目内容
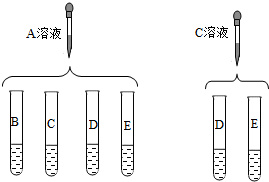 实验室有A、B、C、D、E五瓶失去标签的溶液,所含溶质分别是HCl、H2SO4、NaOH、BaCl2、CuSO4中的一种.首先判断出A为
实验室有A、B、C、D、E五瓶失去标签的溶液,所含溶质分别是HCl、H2SO4、NaOH、BaCl2、CuSO4中的一种.首先判断出A为CuSO4
CuSO4
溶液,理由是溶液呈蓝色
溶液呈蓝色
.实验小组同学又通过以下实验进行鉴别:实验后观察到:A、B混合产生蓝色沉淀,A、C混合产生白色沉淀,C、D混合产生白色沉淀,其余均无明显现象.由此判断:B为
NaOH
NaOH
溶液,C与D反应方程式为BaCl2+H2SO4═BaSO4↓+2HCl
BaCl2+H2SO4═BaSO4↓+2HCl
,A与E能否发生化学反应,理由是不反应,因为不符合复分解反应发生的条件
不反应,因为不符合复分解反应发生的条件
.分析:首先根据硫酸铜溶液是蓝色的,鉴别出硫酸铜;然后根据物质间的反应现象进行分析:能与硫酸铜反应生成蓝色沉淀的是氢氧化钠,硫酸铜可与氯化钡反应生成硫酸钡白色沉淀,氯化钡又可与硫酸反应生成白色硫酸钡沉淀,故D是硫酸,E是盐酸,并依据复分解反应生成物中须有沉淀、气体或水生成判断硫酸铜和盐酸能否发生反应.
解答:解:
五瓶溶液所含溶质分别是HCl、H2SO4、NaOH、BaCl2、CuSO4中的一种,由于硫酸铜溶液是蓝色的,所以首先可鉴别出A是硫酸铜溶液;能与硫酸铜反应生成蓝色沉淀的是氢氧化钠,所以B是氢氧化钠溶液;根据A、C混合产生白色沉淀,硫酸铜可与氯化钡反应生成硫酸钡白色沉淀,可知C是氯化钡溶液;C、D混合产生白色沉淀,氯化钡又可与硫酸反应生成白色硫酸钡沉淀,故D是硫酸,E是盐酸;硫酸铜和盐酸不能发生反应,因为二者的生成物中无气体、沉淀或水,不符合复分解反应的条件;
故答案为:
CuSO4;溶液呈蓝色;NaOH;BaCl2+H2SO4═BaSO4↓+2HCl;不反应,因为不符合复分解反应发生的条件.
五瓶溶液所含溶质分别是HCl、H2SO4、NaOH、BaCl2、CuSO4中的一种,由于硫酸铜溶液是蓝色的,所以首先可鉴别出A是硫酸铜溶液;能与硫酸铜反应生成蓝色沉淀的是氢氧化钠,所以B是氢氧化钠溶液;根据A、C混合产生白色沉淀,硫酸铜可与氯化钡反应生成硫酸钡白色沉淀,可知C是氯化钡溶液;C、D混合产生白色沉淀,氯化钡又可与硫酸反应生成白色硫酸钡沉淀,故D是硫酸,E是盐酸;硫酸铜和盐酸不能发生反应,因为二者的生成物中无气体、沉淀或水,不符合复分解反应的条件;
故答案为:
CuSO4;溶液呈蓝色;NaOH;BaCl2+H2SO4═BaSO4↓+2HCl;不反应,因为不符合复分解反应发生的条件.
点评:本题考查了物质的鉴别,掌握物质的性质及相互之间的化学反应及现象是解答此类题目的关键.

练习册系列答案
相关题目

 (2006?西城区二模)实验室有A、B、C、D、E五瓶失去标签的溶液,已知它们分别是碳酸钠、氯化钡、硝酸钙、稀硫酸和硝酸银中的某一种溶液.如图为常温时上述溶液两两混合的部分实验现象,其中“↑”表示有气体生成,“↓”表示有沉淀生成,“-”表示无明显现象或有微溶物生成.根据实验结果回答下列问题:
(2006?西城区二模)实验室有A、B、C、D、E五瓶失去标签的溶液,已知它们分别是碳酸钠、氯化钡、硝酸钙、稀硫酸和硝酸银中的某一种溶液.如图为常温时上述溶液两两混合的部分实验现象,其中“↑”表示有气体生成,“↓”表示有沉淀生成,“-”表示无明显现象或有微溶物生成.根据实验结果回答下列问题: