题目内容
酸、碱、盐知识是中学化学的重要组成部分,亮亮同学针对本部分内容进行了一系列的探究学习.(1)溶解性表是学习化学的重要工具.亮亮同学研究了“部分酸、碱、盐在20℃时的溶解性”(如右表),认为其中的
| OH- | N
|
Cl- | C
|
S
| |||||||
| H+ | 溶、挥 | 溶、挥 | 溶、挥 | 溶 | |||||||
| Ca2+ | 微 | 溶 | 溶 | 不 | 微 | ||||||
| Ba2+ | 溶 | 溶 | 溶 | 不 | 不 | ||||||
| Cu2+ | 不 | 溶 | 溶 | 不 | 溶 |
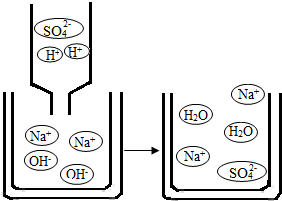
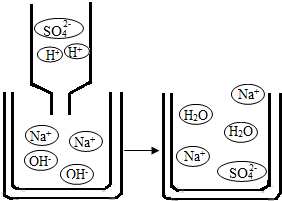
(3)硫酸是中学常见的酸.亮亮欲将50g 98%的浓硫酸稀释成24、5%的稀硫酸,需量取水
(4)在实验室,亮亮发现一瓶氢氧化钠固体试剂因敞口放置,已部分发生了变质.
①为得知该瓶药品的变质程度,亮亮设计了如下实验方案:取10g样品(假设部分变质后的样品组成为氢氧化钠和碳酸钠),加入100g稀硫酸(过量)使之充分反应,发现反应后剩余溶液的质量为107.8g.请计算该样品中氢氧化钠的质量分数.
分析:(1)根据溶解性表表示的意义解答,“不”表示物质不溶于水,“微”表示物质微溶于水,“溶”表示物质能溶于水;
(2)酸碱中和的实质就是氢离子和氢氧根离子结合成水;
(3)溶液稀释前后溶质的质量不变,稀释浓硫酸时要把浓硫酸倒入水中;
(4)根据质量守恒计算出生成二氧化碳的质量,然后根据碳酸钠和盐酸反应的化学方程式求出碳酸钠质量,进而计算氢氧化钠的质量分数.
(2)酸碱中和的实质就是氢离子和氢氧根离子结合成水;
(3)溶液稀释前后溶质的质量不变,稀释浓硫酸时要把浓硫酸倒入水中;
(4)根据质量守恒计算出生成二氧化碳的质量,然后根据碳酸钠和盐酸反应的化学方程式求出碳酸钠质量,进而计算氢氧化钠的质量分数.
解答:解:(1)从溶解性表看出,硫酸钙是微溶性盐,氢氧化钡的可溶碱;故答案为:硫酸钙,Ba(OH)2;
(2)观察稀硫酸和氢氧化钠溶液反应的微观示意图,从粒子角度分析,该反应发生的实质是 H+与OH-反应生成水.
故答案为:H+与OH-反应生成水;
(3)设需要水的质量为x,根据稀释前后溶质质量不变可得:50g×98%=(50g+x)×24.5% 解得x=150g;
稀释浓硫酸时一定要把浓硫酸倒入水在,具体的操作过程为 用量筒量取150 mL水注入烧杯中,将浓硫酸沿烧杯内壁缓缓倒入水中,并用玻璃棒不断搅拌散热.
故答案为:150g,用量筒量取150 mL水注入烧杯中,将浓硫酸沿烧杯内壁缓缓倒入水中,并用玻璃棒不断搅拌散热.
(4)①设样品中碳酸钠的质量为x.
依题意,样品与稀硫酸反应放出CO2质量为:100g+10g-107.8g=2.2 g
Na2CO3+H2SO4 ═Na2SO4+CO2↑+H2O
106 44
x 2.2 g
=
x=5.3 g
则样品中氢氧化钠的质量分数为:
×100%=47%
答:样品中氢氧化钠的质量分数为47%.
(2)观察稀硫酸和氢氧化钠溶液反应的微观示意图,从粒子角度分析,该反应发生的实质是 H+与OH-反应生成水.
故答案为:H+与OH-反应生成水;
(3)设需要水的质量为x,根据稀释前后溶质质量不变可得:50g×98%=(50g+x)×24.5% 解得x=150g;
稀释浓硫酸时一定要把浓硫酸倒入水在,具体的操作过程为 用量筒量取150 mL水注入烧杯中,将浓硫酸沿烧杯内壁缓缓倒入水中,并用玻璃棒不断搅拌散热.
故答案为:150g,用量筒量取150 mL水注入烧杯中,将浓硫酸沿烧杯内壁缓缓倒入水中,并用玻璃棒不断搅拌散热.
(4)①设样品中碳酸钠的质量为x.
依题意,样品与稀硫酸反应放出CO2质量为:100g+10g-107.8g=2.2 g
Na2CO3+H2SO4 ═Na2SO4+CO2↑+H2O
106 44
x 2.2 g
| 106 |
| x |
| 44 |
| 2.2g |
x=5.3 g
则样品中氢氧化钠的质量分数为:
| 10g-5.3g |
| 10g |
答:样品中氢氧化钠的质量分数为47%.
点评:本题综合考查了酸碱盐的溶解性,酸碱中和的实质,溶液的稀释,根据化学方程式的计算等重要的知识点,难度比较大,同学们要认真完成.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
某中学同学学完第十一单元后,在教师的指导下对“酸、碱、盐之间并不是都能发生复分解反应,发生复分解反应应具备哪些条件?”设计了如下科学探究活动.
(1)提出问题:发生复分解反应应具备哪些条件?
(2)猜想与假设:①酸、碱、盐的溶液混和后溶液中自由移动的离子变少了,反应就发生了;②酸、碱、盐的溶液混和后,肉眼能看到新物质的产生(例如,有沉淀或气体),反应才发生.
(3)进行实验并观察实验现象,请结合实验完成下表:
(4)解释与结论:
上述反应为什么能够发生?是因为在这些反应物中有特殊的阴、阳离子,它们两两结合生成了沉淀或气体或水.如①中有Ba2++SO42-→BaSO4↓,②中有H++CO32-→H2O+CO2↑,③中有H++OH-→H2O,④中有 ,⑤中有 ,从而使化学反应得以发生.经过分析,同学们得出的结论,猜想 正确.
(5)形成网络:按照一定的顺序排列某些离子,就可以形成一个知识网络.在网络中,用“---”相连接的阴、阳离子之间能两两结合生成沉淀或气体或水.现有Ca2+、HCO3-、NH4+三种离子,请将它们填入合适的“ ”内,使其形成一个更完整的复分解反应的知识网络.
”内,使其形成一个更完整的复分解反应的知识网络.

(6)拓展应用:根据得出的结论,解决以下问题:
t℃时四种化合物在溶剂A和溶剂B的溶解度如下表:
t℃时表中四种化合物在溶剂A中发生复分解反应的化学方程式为BaCl2+2AgNO3=2AgCl↓+Ba(NO3)2,则表中四种化合物中某两种化合物在溶剂B中发生复分解反应的化学方程式为 .
(1)提出问题:发生复分解反应应具备哪些条件?
(2)猜想与假设:①酸、碱、盐的溶液混和后溶液中自由移动的离子变少了,反应就发生了;②酸、碱、盐的溶液混和后,肉眼能看到新物质的产生(例如,有沉淀或气体),反应才发生.
(3)进行实验并观察实验现象,请结合实验完成下表:
| 实验步骤 | 实验现象 | 化学反应方程式 |
| ①硝酸钡溶液中滴加稀硫酸 | H2SO4+Ba(NO3)2=BaSO4↓+2HNO3 | |
| ②稀硫酸溶液中滴加碳酸钾溶液 | H2SO4+K2CO3=K2SO4+CO2↑+H2O | |
| ③稀盐酸溶液中先加2滴酚酞试液再滴加氢氧化钠溶液 | 溶液由无色变浅红色,并不褪色 | |
| ④硝酸钡溶液中滴加碳酸钾溶液 | 有白色沉淀 | |
| ⑤氯化铵溶液中滴加浓氢氧化钠溶液后加热,并用湿的红石蕊试纸检验生成的气体 | 有无色、刺激性气味的气体生成,该气体能使湿的红石蕊试纸变蓝 |
上述反应为什么能够发生?是因为在这些反应物中有特殊的阴、阳离子,它们两两结合生成了沉淀或气体或水.如①中有Ba2++SO42-→BaSO4↓,②中有H++CO32-→H2O+CO2↑,③中有H++OH-→H2O,④中有
(5)形成网络:按照一定的顺序排列某些离子,就可以形成一个知识网络.在网络中,用“---”相连接的阴、阳离子之间能两两结合生成沉淀或气体或水.现有Ca2+、HCO3-、NH4+三种离子,请将它们填入合适的“
 ”内,使其形成一个更完整的复分解反应的知识网络.
”内,使其形成一个更完整的复分解反应的知识网络.
(6)拓展应用:根据得出的结论,解决以下问题:
t℃时四种化合物在溶剂A和溶剂B的溶解度如下表:
| 物质 | 在溶剂A中的溶解度/g | 在溶剂B中的溶解度/g |
| AgNO3 | 170 | 86 |
| Ba(NO3)2 | 9.3 | 97.2 |
| AgCl | 1.5×10-4 | 0.8 |
| BaCl2 | 33.3 | 约为0 |
酸、碱、盐知识是中学化学的重要组成部分,亮亮同学针对本部分内容进行了一系列的探究学习.
(1)溶解性表是学习化学的重要工具.亮亮同学研究了“部分酸、碱、盐在20℃时的溶解性”(如右表),认为其中的______(填物质名称)是一种微溶于水的盐,______(填物质化学式)是一种可溶于水的碱.
| OH- | N | Cl- | C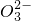 | S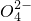 | |
| H+ | 溶、挥 | 溶、挥 | 溶、挥 | 溶 | |
| Ca2+ | 微 | 溶 | 溶 | 不 | 微 |
| Ba2+ | 溶 | 溶 | 溶 | 不 | 不 |
| Cu2+ | 不 | 溶 | 溶 | 不 | 溶 |
(3)硫酸是中学常见的酸.亮亮欲将50g 98%的浓硫酸稀释成24、5%的稀硫酸,需量取水______g,在浓硫酸的稀释过程中,亮亮的操作方法应为______.
(4)在实验室,亮亮发现一瓶氢氧化钠固体试剂因敞口放置,已部分发生了变质.
①为得知该瓶药品的变质程度,亮亮设计了如下实验方案:取10g样品(假设部分变质后的样品组成为氢氧化钠和碳酸钠),加入100g稀硫酸(过量)使之充分反应,发现反应后剩余溶液的质量为107.8g.请计算该样品中氢氧化钠的质量分数.
酸、碱、盐知识是中学化学的重要组成部分,亮亮同学针对本部分内容进行了一系列的探究学习.
(1)溶解性表是学习化学的重要工具.亮亮同学研究了“部分酸、碱、盐在20℃时的溶解性”(如右表),认为其中的______(填物质名称)是一种微溶于水的盐,______(填物质化学式)是一种可溶于水的碱.
(2)下图是稀硫酸和氢氧化钠溶液反应的微观示意图,从粒子角度分析,该反应发生的实质是______.
(3)硫酸是中学常见的酸.亮亮欲将50g 98%的浓硫酸稀释成24、5%的稀硫酸,需量取水______g,在浓硫酸的稀释过程中,亮亮的操作方法应为______.
(4)在实验室,亮亮发现一瓶氢氧化钠固体试剂因敞口放置,已部分发生了变质.
①为得知该瓶药品的变质程度,亮亮设计了如下实验方案:取10g样品(假设部分变质后的样品组成为氢氧化钠和碳酸钠),加入100g稀硫酸(过量)使之充分反应,发现反应后剩余溶液的质量为107.8g.请计算该样品中氢氧化钠的质量分数.
(1)溶解性表是学习化学的重要工具.亮亮同学研究了“部分酸、碱、盐在20℃时的溶解性”(如右表),认为其中的______(填物质名称)是一种微溶于水的盐,______(填物质化学式)是一种可溶于水的碱.
| OH- | N | Cl- | C | S | |
| H+ | 溶、挥 | 溶、挥 | 溶、挥 | 溶 | |
| Ca2+ | 微 | 溶 | 溶 | 不 | 微 |
| Ba2+ | 溶 | 溶 | 溶 | 不 | 不 |
| Cu2+ | 不 | 溶 | 溶 | 不 | 溶 |

(3)硫酸是中学常见的酸.亮亮欲将50g 98%的浓硫酸稀释成24、5%的稀硫酸,需量取水______g,在浓硫酸的稀释过程中,亮亮的操作方法应为______.
(4)在实验室,亮亮发现一瓶氢氧化钠固体试剂因敞口放置,已部分发生了变质.
①为得知该瓶药品的变质程度,亮亮设计了如下实验方案:取10g样品(假设部分变质后的样品组成为氢氧化钠和碳酸钠),加入100g稀硫酸(过量)使之充分反应,发现反应后剩余溶液的质量为107.8g.请计算该样品中氢氧化钠的质量分数.
