题目内容
实验室里有一瓶标签残缺的盐酸,请你探究.
(1)怎样立即确定它是不是浓盐酸?你认为应该用________方法(填序号),就可立即确认.
A.讨论
B.调查
C.实验
D.上网
具体做法是________.
(2)粗略测定1 mL盐酸溶液中溶质的质量.同学们依据酸与碱发生中和反应的原理,设计了一套可行的实验方案,其操作步骤如下:
第一步:在小烧杯中加入10 g 5%的NaOH溶液;
第二步:向上述烧杯中滴入2滴酚酞试液;
第三步:向10 mL的量筒里注入该盐酸至一定刻度;
第四步:用胶头滴管吸取量筒中的盐酸,逐滴滴入上述烧杯中,一直滴到溶液由红色刚刚变成无色为止;
第五步:记录实验数据;
第六步:计算,确定1 mL盐酸中溶质的质量.
请你根据以上实验过程,回答下列问题:
①该实验中选用酚酞试液的原因是________.
②第三步中向量筒中注入盐酸,量筒的液面位置如图所示,A与B和B与C的刻度间均相差1 mL,如果刻度A为8 mL,量筒中的盐酸的体积为________mL.
③第四步中要用到玻璃棒,它的作用是________,目的是________.停止滴入盐酸后,胶头滴管中残留的盐酸应________.
④笫五步中要记录的实验数据是________.
(3)测定1 mL该盐酸中溶质的质量的原理和方法还有多种,为此大家继续进行探究.有人提出用KOH等碱类试剂取代上述NaOH与盐酸进行中和反应,测定消耗掉盐酸的体积,通过计算确定盐酸中溶质的质量,这和上述实验属于同一种方法.你能写出至少三种其他可行的方法吗?若能,请写在下面(用文字简述所依据的原理和要测定的数据).
方法①________.
方法②________.
方法③________.
(4)请你在上述三种方法中任选一种:方法________,写出按此方法进行实验时所需要的玻璃仪器:________.
解析:
|
答案:(1)C;打开瓶塞,若有白雾冒出,则是浓盐酸,否则不是浓盐酸 (2)①为了指示NaOH和HCl什么时候恰好完全中和;②7.2;③搅拌,使反应物混合均匀,使反应充分进行;全部滴回量筒中;④量筒中剩下的盐酸的体积(或中和反应用去的盐酸的体积) (3)方法①:用一定质量的锌粒(或Fe、Mg等活泼金属)与盐酸反应,测量用去盐酸的体积;方法②:用一定量的CaCO3(或其他碳酸盐)与盐酸反应,测量用去盐酸的体积;方法③:用一定量的CuO等金属氧化物与盐酸反应,测量用去盐酸的体积 (4)①;烧杯、量筒、胶头滴管、玻璃棒(或②;烧杯、量筒、胶头滴管、玻璃棒) 分析:本题具有较强的开放性及综合性.通过对1 mL该盐酸中溶质的质量的测定.能较好地考查学生的实验设计、操作能力,以及对盐酸性质的综合分析、归纳能力. 注意:对探究实验学生可能不太熟悉,可先在教师的指导下进行,学生的实验操作要规范,对实际现象、结果的处理要准确. |

 名校课堂系列答案
名校课堂系列答案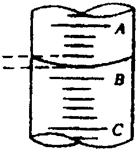
 实验室里有一瓶标签残缺的盐酸,请你来探究:
实验室里有一瓶标签残缺的盐酸,请你来探究: