题目内容
 某化学兴趣小组对一包干燥的红色粉末组成进行探究,该红色粉末可能由Cu、Fe2O3两种固体中的一种或两种组成.
某化学兴趣小组对一包干燥的红色粉末组成进行探究,该红色粉末可能由Cu、Fe2O3两种固体中的一种或两种组成.
[提出猜想]红色粉末可能是:①Cu ②Fe2O3 ③Cu和Fe2O3
[查阅资料](1)白色无水CuSO4遇水变蓝
(2)Cu在FeCl3溶液中发生反应:2FeCl3+Cu═2FeCl2+CuCl2
[实验探究]
[甲组同学]:定性检测该红色粉末的物质组成
(1)小云取少量红色粉末于试管中,滴加足量稀盐酸,充分振荡后观察,发现固体全部溶解,得有色溶液.则猜想________一定不成立,其中一定发生反应的化学方程式为________.
(2)小伟向小云得到的有色溶液中插入一根洁净的铁丝,反应充分后,观察到________现象,得出猜想③成立.
[乙组同学]:定量测定该红色粉末中氧化铁的质量分数
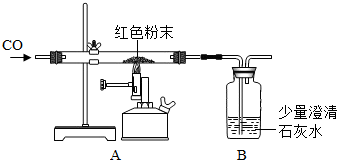
实验步骤:小晨称取该红色粉末5.0g装入硬质玻璃管中,按下图进行实验.开始时缓缓通入CO气体,过一段时间后再高温加热使其充分反应.待反应完全后,停止加热,仍继续通CO气体直至玻璃管冷却.反应前后称量相关物质的总质量(装置内空气中的水蒸气、CO2忽略不计),其数据如下表:
| 反应前 | 反应后 | |
| Ⅰ 组 | 玻璃管和红色粉末的总质量为48.3g | 玻璃管和固体物质的总质量为47.1g |
| Ⅱ 组 | 洗气瓶和瓶中所盛物质的总质量为258.6g | 洗气瓶和瓶中所盛物质的总质量为261.9g |
(1)在装置A中先通CO气体的目的是________.A装置中发生反应的化学方程式为________.
(2)根据上述表格中的实验数据计算:红色粉末中氧化铁的质量分数为________.
(3)从环保角度看上述装置有严重不足之处.你认为应该如何改进?________.
[拓展延伸]对实验后B装置洗气瓶内溶液中是否有NaOH 剩余做进一步探究
实验步骤:小渊同学取该洗气瓶内溶液50克,逐滴加入质量分数为7.3%的稀盐酸至无气泡冒出为止,共用去稀盐酸60克,所得溶液质量为107.8克.试计算:
(1)该洗气瓶内溶液中碳酸钠的溶质质量分数.
(2)50克该洗气瓶内溶液中剩余的氢氧化钠质量为________克.
解:[实验探究]
[甲组同学]:(1)铜和稀盐酸不反应,氧化铁和稀盐酸反应生成氯化铁和水且氯化铁的溶液呈黄色,故答案:猜想①一定不成立; Fe2O3+6HCl=2FeCl3+3H2O
(2)Fe2O3+6HCl=2FeCl3+3H2O,又Cu在FeCl3溶液中发生反应:2FeCl3+Cu=2FeCl2+CuCl2,所以铁和氯化铜反应生成铜和氯化亚铁,铁丝表面附着一层红色的铜,故答案:铁丝表面有红色物质生成
[乙组同学]:
[交流讨论]
(1)一氧化碳不纯遇火会发生爆炸,一氧化碳和氧化铁反应生成铁和二氧化碳.故答案:排尽玻璃管内的空气 3CO+Fe2O3 2Fe+3CO2
2Fe+3CO2
(2)洗气瓶增重的质量即A中反应生成的二氧化碳的质量为261.9g-258.6g=3.3g
设5g固体中氧化铁的质量为x
3CO+Fe2O3 2Fe+3CO2
2Fe+3CO2
160 44×3
x 3.3g
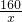 =
=
x=4g
固体中氧化铁的质量分数为 ×100%=80%
×100%=80%
故答案:80%
(3)一氧化碳有毒不能直接排放,故答案:缺少尾气处理装置;可以在导管口放点燃酒精灯,将一氧化碳烧掉;
[拓展延伸]生成二氧化碳的质量为50g+60g-107.8g=2.2g
设:50克溶液中碳酸钠的质量为y,和碳酸钠反应的氯化氢的质量为z
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 73 44
y z 2.2g
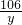 =
=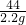
y=5.3g
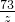 =
=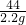
z=3.65g
(1)溶液中碳酸钠的质量分数为 ×100%=10.6%
×100%=10.6%
答:洗气瓶内溶液中碳酸钠的溶质质量分数为10.6%
(2)所用盐酸中氯化氢的质量为:60g×7.3%=4.38g
和氢氧化钠反应的氯化氢的质量为4.38g-3.65g=0.73g
设所取溶液中氢氧化钠的质量为a
NaOH+HCl=NaCl+H2O
40 36.5
a 0.73g
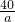 =
=
a=0.8g
故答案:0.8g
分析:[实验探究]
[甲组同学]:(1)根据铜和稀盐酸不反应,氧化铁和稀盐酸反应生成氯化铁和水且氯化铁的溶液呈黄色分析.
(2)根据铁和氯化铜反应生成铜和氯化亚铁分析.
[乙组同学]:(1)根据一氧化碳不纯遇火会发生爆炸、一氧化碳和氧化铁反应生成铁和二氧化碳分析.
(2)根据二氧化碳和氢氧化钠反应生成碳酸钠和水所以洗气瓶增重的质量就是A中得到的二氧化碳的质量分析计算.
(3)根据一氧化碳有毒不能直接排放分析.
[拓展延伸](1)根据反应前后物质减轻的质量即为碳酸钠和稀盐酸反应生成二氧化碳的质量,然后根据碳酸钠和稀盐酸反应的化学方程式计算.
(2)根据碳酸钠和稀盐酸反应生成二氧化碳的质量求出和碳酸钠反应的盐酸的质量,剩下的就是和氢氧化钠反应的稀盐酸,然后根据氢氧化钠和稀盐酸反应的化学方程式计算即可.
点评:本题考查了炼铁的原理和根据化学方程式的计算,关键是分析清楚装置的反应和反应前后质量变化的原因.
[甲组同学]:(1)铜和稀盐酸不反应,氧化铁和稀盐酸反应生成氯化铁和水且氯化铁的溶液呈黄色,故答案:猜想①一定不成立; Fe2O3+6HCl=2FeCl3+3H2O
(2)Fe2O3+6HCl=2FeCl3+3H2O,又Cu在FeCl3溶液中发生反应:2FeCl3+Cu=2FeCl2+CuCl2,所以铁和氯化铜反应生成铜和氯化亚铁,铁丝表面附着一层红色的铜,故答案:铁丝表面有红色物质生成
[乙组同学]:
[交流讨论]
(1)一氧化碳不纯遇火会发生爆炸,一氧化碳和氧化铁反应生成铁和二氧化碳.故答案:排尽玻璃管内的空气 3CO+Fe2O3
 2Fe+3CO2
2Fe+3CO2(2)洗气瓶增重的质量即A中反应生成的二氧化碳的质量为261.9g-258.6g=3.3g
设5g固体中氧化铁的质量为x
3CO+Fe2O3
 2Fe+3CO2
2Fe+3CO2160 44×3
x 3.3g
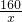 =
=
x=4g
固体中氧化铁的质量分数为
 ×100%=80%
×100%=80%故答案:80%
(3)一氧化碳有毒不能直接排放,故答案:缺少尾气处理装置;可以在导管口放点燃酒精灯,将一氧化碳烧掉;
[拓展延伸]生成二氧化碳的质量为50g+60g-107.8g=2.2g
设:50克溶液中碳酸钠的质量为y,和碳酸钠反应的氯化氢的质量为z
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 73 44
y z 2.2g
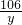 =
=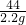
y=5.3g
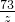 =
=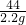
z=3.65g
(1)溶液中碳酸钠的质量分数为
 ×100%=10.6%
×100%=10.6% 答:洗气瓶内溶液中碳酸钠的溶质质量分数为10.6%
(2)所用盐酸中氯化氢的质量为:60g×7.3%=4.38g
和氢氧化钠反应的氯化氢的质量为4.38g-3.65g=0.73g
设所取溶液中氢氧化钠的质量为a
NaOH+HCl=NaCl+H2O
40 36.5
a 0.73g
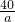 =
=
a=0.8g
故答案:0.8g
分析:[实验探究]
[甲组同学]:(1)根据铜和稀盐酸不反应,氧化铁和稀盐酸反应生成氯化铁和水且氯化铁的溶液呈黄色分析.
(2)根据铁和氯化铜反应生成铜和氯化亚铁分析.
[乙组同学]:(1)根据一氧化碳不纯遇火会发生爆炸、一氧化碳和氧化铁反应生成铁和二氧化碳分析.
(2)根据二氧化碳和氢氧化钠反应生成碳酸钠和水所以洗气瓶增重的质量就是A中得到的二氧化碳的质量分析计算.
(3)根据一氧化碳有毒不能直接排放分析.
[拓展延伸](1)根据反应前后物质减轻的质量即为碳酸钠和稀盐酸反应生成二氧化碳的质量,然后根据碳酸钠和稀盐酸反应的化学方程式计算.
(2)根据碳酸钠和稀盐酸反应生成二氧化碳的质量求出和碳酸钠反应的盐酸的质量,剩下的就是和氢氧化钠反应的稀盐酸,然后根据氢氧化钠和稀盐酸反应的化学方程式计算即可.
点评:本题考查了炼铁的原理和根据化学方程式的计算,关键是分析清楚装置的反应和反应前后质量变化的原因.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
某化学兴趣小组对一包干燥的红色粉末组成进行探究.请你参与并回答有关问题.
【教师提醒】它由Cu、Fe2O3二种固体中的一种或两种组成.
【提出猜想】红色粉末可能的组成有:①只有Cu;②只有 ;③是Cu、Fe2O3的混合物
【资料获悉】Cu在FeCl3溶液中发生反应:2FeCl3+Cu═2FeCl2+CuCl2
【实验探究】
(1)甲同学取少量红色粉末于试管中,滴加足量稀盐酸,振荡后观察,发现固体全部溶解.甲同学认为可以排除猜想中的①和③,而乙同学认为只能排除猜想①,你认为 的观点正确(填“甲”或“乙”).
 (2)丙同学为进一步确定红色粉末的组成,称取该粉末5.0g装入硬质玻璃管中,按右图在通风橱中进行实验.开始时缓缓通入CO气体,过一段时间后再加热使其充分反应.待反应完全后,停止加热,仍继续通CO气体直至玻璃管冷却.反应前后称量相关装置和物质的总质量,其数据如下表:
(2)丙同学为进一步确定红色粉末的组成,称取该粉末5.0g装入硬质玻璃管中,按右图在通风橱中进行实验.开始时缓缓通入CO气体,过一段时间后再加热使其充分反应.待反应完全后,停止加热,仍继续通CO气体直至玻璃管冷却.反应前后称量相关装置和物质的总质量,其数据如下表:
【交流讨论】
(1)在装置A中先通CO气体的作用是 .
(2)应该选择 组的实验数据计算来确定红色粉末的组成.最终计算结果表明:该红色粉末的组成是猜想中的第 组(填序号).
(3)写出A装置中发生反应的化学方程式 ;实验中观察到A装置中的现象为 .
(4)为了防止溶液倒吸,本实验停止加热前是否需要先断开A和B的连接处? (填“需要”或“不需要”),理由是 .
【反思评价】丁同学指出:从环保角度,上图装置有严重不足之处.你认为应该如何改进? .
【教师提醒】它由Cu、Fe2O3二种固体中的一种或两种组成.
【提出猜想】红色粉末可能的组成有:①只有Cu;②只有
【资料获悉】Cu在FeCl3溶液中发生反应:2FeCl3+Cu═2FeCl2+CuCl2
【实验探究】
(1)甲同学取少量红色粉末于试管中,滴加足量稀盐酸,振荡后观察,发现固体全部溶解.甲同学认为可以排除猜想中的①和③,而乙同学认为只能排除猜想①,你认为
 (2)丙同学为进一步确定红色粉末的组成,称取该粉末5.0g装入硬质玻璃管中,按右图在通风橱中进行实验.开始时缓缓通入CO气体,过一段时间后再加热使其充分反应.待反应完全后,停止加热,仍继续通CO气体直至玻璃管冷却.反应前后称量相关装置和物质的总质量,其数据如下表:
(2)丙同学为进一步确定红色粉末的组成,称取该粉末5.0g装入硬质玻璃管中,按右图在通风橱中进行实验.开始时缓缓通入CO气体,过一段时间后再加热使其充分反应.待反应完全后,停止加热,仍继续通CO气体直至玻璃管冷却.反应前后称量相关装置和物质的总质量,其数据如下表:| 反应前 | 反应后 | |
| Ⅰ组 | 玻璃管和红色粉末的总质量为37.3g | 玻璃管和固体物质的总质量为36.1g |
| Ⅱ组 | 洗气瓶和所盛溶液的总质量为180.0g | 洗气瓶和瓶中物质的总质量为183.1g |
(1)在装置A中先通CO气体的作用是
(2)应该选择
(3)写出A装置中发生反应的化学方程式
(4)为了防止溶液倒吸,本实验停止加热前是否需要先断开A和B的连接处?
【反思评价】丁同学指出:从环保角度,上图装置有严重不足之处.你认为应该如何改进?
 某化学兴趣小组对一包干燥的红色粉末组成进行探究.请你参与并回答有关问题.
某化学兴趣小组对一包干燥的红色粉末组成进行探究.请你参与并回答有关问题.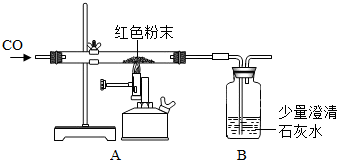
 红枣中含有丰富的VC和糖类,常食能增强人体的免疫力,有补血养气安神等良好功效,红枣包装中常使用一种袋装防腐剂,品名为“504双吸剂”,其标签如图所示.
红枣中含有丰富的VC和糖类,常食能增强人体的免疫力,有补血养气安神等良好功效,红枣包装中常使用一种袋装防腐剂,品名为“504双吸剂”,其标签如图所示.