题目内容
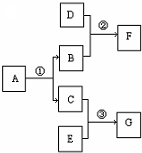 (2009?海淀区二模)A~G是初中化学常见的七种物质,相互转化关系如右图(其中部分反应物、生成物和反应条件略).请回答下列问题.
(2009?海淀区二模)A~G是初中化学常见的七种物质,相互转化关系如右图(其中部分反应物、生成物和反应条件略).请回答下列问题.若A常温下发生反应常使用催化剂,B为空气中存在的一种气态单质,F为黑色固体,D在潮湿的空气中容易生锈,G可使紫色石蕊试液变红,②③反应类型相同.反应①的化学方程式为
2H2O2
2H2O+O2↑
| ||
2H2O2
2H2O+O2↑
;反应②中的实验现象为
| ||
剧烈燃烧,火星四射,生成黑色固体,放出大量的热
剧烈燃烧,火星四射,生成黑色固体,放出大量的热
.(1)若①②③均发生的是复分解反应,且①②反应中均有沉淀产生,③反应中有气泡产生,写出①②③发生反应的化学方程式.①
Na2CO3+Ca(OH)2=CaCO3 ↓+2NaOH
Na2CO3+Ca(OH)2=CaCO3 ↓+2NaOH
;②2NaOH+MgCl2=Mg(OH)2 ↓+2NaCl
2NaOH+MgCl2=Mg(OH)2 ↓+2NaCl
;③CaCO3+2HCl=CaCl2+CO2↑+H2O
CaCO3+2HCl=CaCl2+CO2↑+H2O
.(2)若A、C、G为单质,①和③的反应类型相同,A和G相对原子质量之比为3:8,B和E相对分子质量之比为3:2,且含有一种相同元素.写出①和③反应的化学方程式
①
Mg+H2SO4=MgSO4+H2↑
Mg+H2SO4=MgSO4+H2↑
、③CuO+H2
Cu+H2O
| ||
CuO+H2
Cu+H2O
.
| ||
分析:(1)若A常温下发生反应常使用催化剂,B为空气中存在的一种气态单质,F为黑色固体,D在潮湿的空气中容易生锈,G可使紫色石蕊试液变红,可推知A是双氧水,B是氧气C是水,D是铁,F是四氧化三铁据此回答问题即可,
(2)③中有气泡生成又是复分解反应,所以可知是碳酸盐与酸的反应,据此分析问题即可.
(3)若A、C、G为单质,①和③的反应类型相同,结合图示可知该反应的类型为置换反应,据此展开讨论并书写有关的方程式即可;
(2)③中有气泡生成又是复分解反应,所以可知是碳酸盐与酸的反应,据此分析问题即可.
(3)若A、C、G为单质,①和③的反应类型相同,结合图示可知该反应的类型为置换反应,据此展开讨论并书写有关的方程式即可;
解答:解:(1)若A常温下发生反应常使用催化剂,B为空气中存在的一种气态单质,F为黑色固体,D在潮湿的空气中容易生锈,G可使紫色石蕊试液变红,可推知A是双氧水,B是氧气C是水,D是铁,F是四氧化三铁,E是二氧化碳,G是碳酸据此回答相关问题;
(2)③中有气泡生成又是复分解反应,所以可知是碳酸盐与酸的反应,这就要求①必须生成碳酸盐的沉淀,结合复分解反应的要求可知①可以是:Na2CO3+Ca(OH)2=CaCO3 ↓+2NaOH;
且①②反应中均有沉淀产生所以②可以是2NaOH+MgCl2=Mg(OH)2 ↓+2NaCl;这样③便是CaCO3+2HCl=CaCl2+CO2↑+H2O;
(3)若A、C、G为单质,①和③的反应类型相同,结合图示可知该反应的类型为置换反应,结合只有这样才能符合图示所展示的转化关系,A和G相对原子质量之比为3:8,所以①③的方程式应该是①Mg+H2SO4=MgSO4+H2↑ ③CuO+H2
Cu+H2O,B和E相对分子质量之比为3:2,且含有一种相同元素,则B是MgSO4正好符合.
故答案为:
(1)2H2O2
2H2O+O2↑剧烈燃烧,火星四射,放出大量热,生成黑色固体.
(2)①Na2CO3+Ca(OH)2=CaCO3 ↓+2NaOH②2NaOH+MgCl2=Mg(OH)2 ↓+2NaCl③CaCO3+2HCl=CaCl2+CO2↑+H2O.
(3)①Mg+H2SO4=MgSO4+H2↑ ③CuO+H2
Cu+H2O.
(2)③中有气泡生成又是复分解反应,所以可知是碳酸盐与酸的反应,这就要求①必须生成碳酸盐的沉淀,结合复分解反应的要求可知①可以是:Na2CO3+Ca(OH)2=CaCO3 ↓+2NaOH;
且①②反应中均有沉淀产生所以②可以是2NaOH+MgCl2=Mg(OH)2 ↓+2NaCl;这样③便是CaCO3+2HCl=CaCl2+CO2↑+H2O;
(3)若A、C、G为单质,①和③的反应类型相同,结合图示可知该反应的类型为置换反应,结合只有这样才能符合图示所展示的转化关系,A和G相对原子质量之比为3:8,所以①③的方程式应该是①Mg+H2SO4=MgSO4+H2↑ ③CuO+H2
| ||
故答案为:
(1)2H2O2
| ||
(2)①Na2CO3+Ca(OH)2=CaCO3 ↓+2NaOH②2NaOH+MgCl2=Mg(OH)2 ↓+2NaCl③CaCO3+2HCl=CaCl2+CO2↑+H2O.
(3)①Mg+H2SO4=MgSO4+H2↑ ③CuO+H2
| ||
点评:此题的开放型较大,解题的关键是抓住信息中有关的突破口,并结合对所学的化学反应的数量掌握程度分析解答,只有这样才能顺利解题.

练习册系列答案
相关题目
 表示氢原子,
表示氢原子, 表示碳原子,
表示碳原子, 表示氧原子.请推断下列说法中正确的是( )
表示氧原子.请推断下列说法中正确的是( )
 ,则X的值为
,则X的值为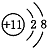 B、
B、 C、
C、 D、
D、