题目内容
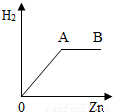
锌和稀H2SO4反应生成H2,几次实验锌的用量不同,H2SO4用量相同,锌的用量和生成H2的体积(同温、同压)的关系如图所示:①锌和过量的H2SO4反应在图中的 处
②锌与适量的H2SO4恰好完全反应在图中 处
③过量的锌和H2SO4反应表示在图中的 处.
【答案】分析:根据锌与稀硫酸的反应结合图象进行分析,从图象可以看出OA段是生成的氢气量不断增加,到A点氢气量最大,可知在A点时稀硫酸正好用完,再继续加锌氢气量不再变大,所以A点是该反应的转折点,此点表示的是酸中的氢元素恰好全部转化为氢气两者恰好反应,据此分析解答即可
解答:解:由锌与稀硫酸的反应,观察图象可知,
①锌和过量的H2SO4反应,在锌未反应完时,生成的氢气的质量不断增加,当锌全部参加反应时生成的氢气最多,在图中的O-A处;
②当锌与适量的H2SO4恰好完全反应时,生成的氢气最多,在图中A处;
③过量的锌和H2SO4反应时,不在产生氢气,氢气的质量达到最大,同时也是定值,在图中的 A-B处.
故答为:①O-A;②A;③A-B
点评:此题是对金属与酸反应的考查,解题的关键是针对图象对相关过程的分析,并抓住转折点的含义.
解答:解:由锌与稀硫酸的反应,观察图象可知,
①锌和过量的H2SO4反应,在锌未反应完时,生成的氢气的质量不断增加,当锌全部参加反应时生成的氢气最多,在图中的O-A处;
②当锌与适量的H2SO4恰好完全反应时,生成的氢气最多,在图中A处;
③过量的锌和H2SO4反应时,不在产生氢气,氢气的质量达到最大,同时也是定值,在图中的 A-B处.
故答为:①O-A;②A;③A-B
点评:此题是对金属与酸反应的考查,解题的关键是针对图象对相关过程的分析,并抓住转折点的含义.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 锌和稀H2SO4反应生成H2,几次实验锌的用量不同,H2SO4用量相同,锌的用量和生成H2的体积(同温、同压)的关系如图所示:
锌和稀H2SO4反应生成H2,几次实验锌的用量不同,H2SO4用量相同,锌的用量和生成H2的体积(同温、同压)的关系如图所示: