题目内容
【题目】下列物质属于纯净物的是
A.干冰B.矿泉水C.石蕊溶液D.带锈的铁钉
【答案】A
【解析】
A、干冰是由一种物质组成,属于纯净物,符合题意;
B、矿泉水含有水和矿物质,属于混合物,不符合题意;
C、石蕊溶液中含有石蕊、水等物质,属于混合物,不符合题意;
D、带锈的铁钉中含有铁和铁锈等物质,属于混合物,不符合题意。故选A。

 精英口算卡系列答案
精英口算卡系列答案【题目】某兴趣小组为验证质量守恒定律,做了镁条在空气中燃烧的实验。
(1)请写出镁条与氧气反应的化学方程式 ;
(2)小明发现燃烧产物的质量大于反应物镁条的质量,认为这个反应不遵循质量守恒定律。我 (“同意”或“不同意”)小明的观点,因为 ;
(3)小红按下图装置改进实验,验证了质量守恒定律,却发现产物中还有少量黄色固体。
【提出问题】黄色固体是什么呢?
【查阅资料】①氧化镁为白色固体;②镁能与氮气剧烈反应生成黄色的氮化镁(Mg3N2)固体③氮化镁可与水剧烈反应产生氨气,该气体能使湿润的红色石蕊试纸变蓝。

【做出猜想】黄色固体是Mg3N2。
【实验探究】请设计实验,验证猜想:
实验操作 | 实验现象及结论 |
【反思与交流】空气中N2含量远大于O2的含量,而镁条在空气中燃烧生成的MgO却远多于Mg3N2,为什么呢?请给出合理的解释:
【答案】(1)2Mg+O2 ![]() 2MgO
2MgO
(2)不同意,参加反应的镁条的质量与氧气的质量之和等于生成的氧化镁的质量
(3)实验操作:取黄色固体放入试管中,滴入水,然后再试管口放一张湿润的红色石蕊试纸;
实验现象及结论:湿润的红色石蕊试纸变蓝,该黄色固体是氮化镁;氧气的化学性质比氮气活泼。
【解析】
试题分析:(1)镁在昂起中燃烧生成的是氧化镁:2Mg+O2 ![]() 2MgO;
2MgO;
(2)化学反应均遵守质量守恒定律,根据质量守恒定律化学反应前后物质的总质量不变,即参加反应的镁的质量与氧气的质量总和等于生成的氧化镁的质量;
(3)根据资料可知,氮化镁与水反应会生成能使湿润的红色石蕊试纸变蓝,故取黄色固体放入试管中,滴入水,然后再试管口放一张湿润的红色石蕊试纸,若湿润的红色石蕊试纸变蓝,证明该黄色固体是氮化镁;由于氧气的化学性质比氮气活泼,故镁在空气中易与氮气反应。
考点:实验探究,质量守恒定律
【题型】实验题
【结束】
15
【题目】逻辑推理时化学学习常用的思维方法,某校研究性学习小组在做“寻找新的催化剂”课题时,发现将生锈的铁钉放到过氧化氢溶液中,也可以加快过氧化氢的分解速率。于是,他们对此展开探究。
【提出问题】什么物质是该反应催化剂?
【查阅资料】铁与氧气、水反应生成铁锈,铁锈的主要成分为氧化铁(Fe2O3)。
【猜想与假设】
假设一:小芳同学认为生锈铁钉表面的氧化铁是H2O2溶液分解反应的催化剂。
假设二:小华同学认为生锈铁钉里的______是H2O2溶液分解反应的催化剂。
【实验与结论】
实验操作 | 实验现象 | 实验结论 |
实验1:把一定质量的氧化铁粉末加入到装有10mL5%的过氧化氢溶液的试管中,并用一根带火星的小木条置于试管口,观察现象。 | ______ | 反应的化学方程式________假设______成立 |
实验2:取10mL5%的过氧化氢溶液于另一支试管中,加入____,并用一根带火星的小木条置于试管口,观察现象。 | 无现象 | 假设二_____(填“成立”或“不成立”) |
【讨论交流】 同学们讨论后认为,小芳的“实验1”还不能够确切的说明氧化铁就是过氧化氢分解的催化剂,理由是:_________________________。
【反思与评价】小强通过仔细观察发现“实验2”中一直没有现象的试管,过了一段时间后试管中也出现了气体,小强觉得很奇怪,你能猜想其中的原因吗?_______________________。
【题目】我国是一个钢铁大国,钢铁产量为世界第一。某化学实验小组的同学用下面的装置在实验室中模拟炼铁。请你和他们一起完成相关探究。
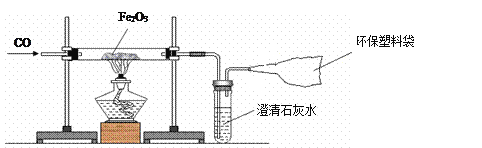
(1)操作顺序是实验成败的关键,对于该实验,应______________________(填“先通入一氧化碳”或“先点燃酒精灯”)。
(2)反应中可观察到粗玻璃管内的实验现象为__________________,写出该反应的化学方程式__________________________________________________。
(3)产物的检验:
①初步检验:甲同学想对反应后的产物进行初步检验,请你帮他想出一个物理方法:______。
②进一步验证:乙同学想用化学方法对产物进一步验证,他将反应后的黑色粉末加入足量的硫酸铜溶液中,发现只有部分变成红色。请写出生成红色物质的化学方程式:____________。
(4)质疑与探究:
①乙同学对产物的成分产生了质疑,查阅相关资料之后得知,一氧化碳还原氧化铁是一个逐渐的过程。
首先是Fe2O3被还原为Fe3O4:3Fe2O3 + CO![]() 2Fe3O4 + CO2。
2Fe3O4 + CO2。
然后是Fe3O4被还原为FeO:CO + Fe3O4![]() ______ + CO2。
______ + CO2。
最后是FeO被还原为Fe:FeO + CO ![]() Fe + CO2
Fe + CO2
②通过以上分析,甲乙两位同学对反应后黑色固体的成分进行了猜想:
已知:FeO、Fe3O4均为黑色,且Fe3O4有磁性。FeO、Fe3O4都不与硫酸铜溶液反应。
猜想一:Fe与Fe3O4; 猜想二:Fe与FeO; 猜想三:Fe与Fe3O4和FeO。
③为了对产物固体的成分进行更客观的分析,甲乙同学将所做实验整理如下:
实验内容 | 实验现象 | 实验结论 |
将反应后得到的黑色粉末 用磁铁吸引 | _____________ | 猜想一成立 |
将反应后得到的黑色粉末 加入足量的硫酸铜溶液中 | _____________ |
④实验反思:为了提高铁的产率,应适当_______(填“降低”或“提高”)反应温度。
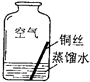
【题目】生活中常遇见铜制品生锈的情况.活动课上,同学们设计实验对铜锈进行了如下探究活动.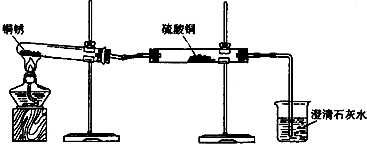
探究活动一:验证铜锈的组成
【査阅资料】①铜锈为绿色,其主要成分是Cu2(OH)2CO3 . ②白色的硫酸铜粉末遇水能变为蓝色.③碳不与稀硫酸反应.④氧化铜为黑色固体,能与稀硫酸反应生成硫酸铜溶液.
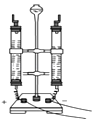
(1)【进行实验1】同学们设计了如图所示装置并进行实验.
实验橾作 | 实验现象 | 实验结论 |
①按如图组装仪器,装入药品. | 绿色固体变为黑色;硫酸铜粉末变为蓝色;烧杯中液体变浑浊. | 加热铜锈生成的物质有; |
③冷却后,向试管中固体 加入适量稀硫酸,稍加热. | 黑色固体溶解,溶液变 为蓝色. |
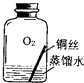
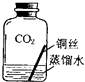
(2)【进行实验2】同学们进行了下面的4个实验,每天观察一次现象,一段时间后,发现只有实验4中的铜丝生锈了,且与水接触的部分生锈更明显.
序号 | 实验内容 | 实验结论 | 实验反思 |
实验1 |
| 在干燥环境中,铜不易生锈 | ①实验2和3中使用的是经煮沸后迅速冷却的蒸馏水,其原因是 . |
实验2 |
| ||
实验3 |
| ||
实验4 |
| 铜生锈的条件是 |