题目内容
山茶油是一种绿色保健品,其主要成分是柠檬醛。现从山茶油中提取76g柠檬醛,将其在氧气中完全燃烧,生成二氧化碳220g,水72g,则柠檬醛的组成中(相对原子质量:H-1 C-12 O-16)( )
A、只含有碳、氢元素
B、一定含有碳、氢、氧元素
C、一定含有碳、氢元素,可能含有氧元素
D、一定含有碳、氧元素,可能含有氢元素
【答案】
B
【解析】试题分析:由生成物CO2和H2O可知,生成物是由C、H、O元素组成。根据质量守恒定律,在化学反应中,元素的种类和质量不变。所以反应物也应由C、H、O元素组成。又因为反应物是柠檬醛和O2,故可初步判断柠檬醛中一定含有C、H元素,可能含有O元素。再根据生成220g二氧化碳和二氧化碳中碳元素的质量分数,计算出生成的二氧化碳中碳元素的质量,也就是柠檬醛中含碳的质量;根据生成水的质量72g和水中氢元素的质量分数,计算出水中氢元素的质量,也就是柠檬醛中含氢的质量;再根据质量守恒定律,76g柠檬醛-柠檬醛中含碳的质量-柠檬醛中含氢的质量=柠檬醛中含氧的质量,进而得出柠檬醛中所含的元素。则柠檬醛中C、H、O的质量分别是:
C:220g×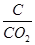 ×100%=220g×
×100%=220g×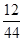 ×100%=60g,
×100%=60g,
H:72g×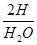 ×100%=72g×
×100%=72g×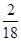 ×100%=8g,
×100%=8g,
O:76g-60g-8g=8g,故选B
考点:本题考查质量守恒定律及其应用,物质的元素组成
点评:解答本题的关键是,掌握质量守恒定律的内容、意义及其应用;了解元素在化学变化过程中的特点。

练习册系列答案
相关题目
“山茶油”是一种绿色保健品,其只要成分是柠檬醛,现从山茶油中提取76g柠檬醛,将其在空气中完全燃烧,生成CO2 220g,H2O 72g,则柠檬醛的组成中( )
| A、一定含有碳、氢、氧元素 | B、只含有碳、氢元素 | C、一定含有碳、氧元素,可能含有氢元素 | D、一定含有碳、氧元素可能含有氢元素 |
2011 年3 月,日本福岛第一核电站发生核辐射泄漏,产生放射性碘-131.吸入放射碘可引发甲状腺疾病.世界卫生组织推荐,一定条件下服用100mg碘,可以减少放射性碘的吸收.试回答:
(1)已知碘的原子序数为53,碘-131原子的相对原子质量为131,则碘-131原子的核外电子数
(2)碘片的主要成分为碘化钾(KI),则碘化钾中碘元素的化合价为
(1)已知碘的原子序数为53,碘-131原子的相对原子质量为131,则碘-131原子的核外电子数
53
53
、中子数为78
78
.(2)碘片的主要成分为碘化钾(KI),则碘化钾中碘元素的化合价为
-1
-1
.其中钾元素与碘元素的质量比为39:127
39:127
.| 配料 氯化纳、碘酸钾(KIO3) 含碘量 20~50mg/kg 保质期 18个月 食用方法 勿长时间炖炒 贮藏指南 避热、密封、防潮(3)有人认为食用碘盐可以防辐射,据合格食盐标签回答: 服用100mg碘元素,至少需要食用 2 2 kg的食盐.由此,学过化学的你,对抢购食盐的做法进行分析判断这种做法是不对的,加碘食盐含碘量低,不能预防辐射 这种做法是不对的,加碘食盐含碘量低,不能预防辐射 .(4)厨房内调味品除了食用碘盐,还有葡萄糖等.已知葡萄糖的化学式为C6H12O6,则葡萄糖中氧元素的质量分数为 53.3% 53.3% (5)山茶油是一种绿色保健品,其主要成分是柠檬醛.现从山茶油中提取76g柠檬醛,将其在氧气中完全燃烧,生成220g二氧化碳和72g水,则柠檬醛的化学式是 C10 H16 O C10 H16 O .
2011 年3 月,日本福岛第一核电站发生核辐射泄漏,产生放射性碘-131.吸入放射碘可引发甲状腺疾病.世界卫生组织推荐,一定条件下服用100mg碘,可以减少放射性碘的吸收.试回答: |
| 配料 氯化纳、碘酸钾(KIO3) 含碘量 20~50mg/kg 保质期 18个月 食用方法 勿长时间炖炒 贮藏指南 避热、密封、防潮 |
服用100mg碘元素,至少需要食用________kg的食盐.由此,学过化学的你,对抢购食盐的做法进行分析判断________.
(4)厨房内调味品除了食用碘盐,还有葡萄糖等.已知葡萄糖的化学式为C6H12O6,则葡萄糖中氧元素的质量分数为________
(5)山茶油是一种绿色保健品,其主要成分是柠檬醛.现从山茶油中提取76g柠檬醛,将其在氧气中完全燃烧,生成220g二氧化碳和72g水,则柠檬醛的化学式是________.