题目内容
某研究小组对用H2O2分解生成H2O和O2的实验条件进行探究.他们进行了以下实验:①往盛有5mL 5% H2O2溶液的试管中,伸入带火星的木条,木条不复燃.
②往盛有5mL w% H2O2溶液的试管中,加入a g MnO2,伸入带火星的木条,木条复燃.
③往盛有5mL w% H2O2溶液的试管中,加入a g Fe2O3,伸入带火星的木条,木条复燃.
④经检验,②、③中反应后试管中仍分别含有a g MnO2和a g Fe2O3.
问题:(1)MnO2、Fe2O3在上述反应中的作用是______.
(2)实验 ②、④中H2O2的浓度(w%)以______为宜.
研究小组还对溶液浓度、催化剂的种类等实验条件进行了探究.下表选取了部分实验数据:
用足量等体积H2O2溶液制取相同体积O2所需的时间
| 浓度 时间(min) 条件 | 30% H2O2 | 15% H2O2 | 5% H2O2 |
| 加入a g MnO2 | 0.2 | 0.8 | 2.0 |
| 加入a g Fe2O3 | 7.0 | 9.0 | 16.0 |
【答案】分析:根据催化剂的特点:改变反应速度而自身的化学性质和质量不变,题目设计了多步实验对此进行检验,通过对比实验的现象和结果,得出两固体的催化作用;然后通过改变过氧化氢溶液的浓度,又对影响反应速度的影响因素进行了进一步探究,通过分析实验数据得出影响因素.
解答:解:(1)对比实验①②④和实验①③④可得到二氧化锰、三氧化二铁在反应中起到了加快反应速度的作用且自身没有改变;
故答案为:催化作用;
(2)因为是对比试验,需要具备相同的实验条件;
故答案为:5%;
(3)对比时间记录表中不同浓度的过氧化氢放出相同体积氧气所消耗时间,可发现H2O2浓度越大,产生氧气的速度越快;对比相同浓度的过氧化氢使不同催化剂时产生相同体积氧气所消耗时间,可发现MnO2的催化效果比Fe2O3好;
故答案为:相同条件下,MnO2的催化效果比Fe2O3好;在其他条件相同的情况下,H2O2浓度越大,产生氧气的速度越快.
点评:实验数据分析时,通过对比发现数据的变化找出造成实验数据变化的原因,从而得出变化的规律.
解答:解:(1)对比实验①②④和实验①③④可得到二氧化锰、三氧化二铁在反应中起到了加快反应速度的作用且自身没有改变;
故答案为:催化作用;
(2)因为是对比试验,需要具备相同的实验条件;
故答案为:5%;
(3)对比时间记录表中不同浓度的过氧化氢放出相同体积氧气所消耗时间,可发现H2O2浓度越大,产生氧气的速度越快;对比相同浓度的过氧化氢使不同催化剂时产生相同体积氧气所消耗时间,可发现MnO2的催化效果比Fe2O3好;
故答案为:相同条件下,MnO2的催化效果比Fe2O3好;在其他条件相同的情况下,H2O2浓度越大,产生氧气的速度越快.
点评:实验数据分析时,通过对比发现数据的变化找出造成实验数据变化的原因,从而得出变化的规律.

练习册系列答案
 活力课时同步练习册系列答案
活力课时同步练习册系列答案
相关题目
归纳与演绎是重要的科学方法,也是常用的化学学习方法.
(1)我们已经学习过实验室制取O2、CO2、H2(Zn和稀硫酸反应)三种气体的反应原理、制取与收集方法.请你归纳出实验室制取气体反应的共同点 (填序号)
①需要加热 ②使用催化剂 ③没有气体参加反应 ④原料为纯净物 ⑤只生成一种气体
(2)下列是实验室常用的仪器
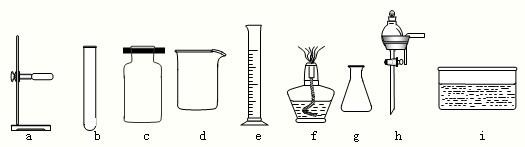
写出仪器名称:a是 ,c是 ;写出d的一种用途 .
(3)化学上可以通过多种反应制得NH3(极易溶于水,密度比空气小),例如
①2NH4Cl(固)+Ca(OH)2(固)
CaCl2+2NH3↑+2H2O
②NH4HCO3(固)
NH3↑+CO2↑+H2O
③CaO(固)+NH3.H2O(浓)═NH3↑+Ca(OH)2
我将选择反应 (只写一个,填序号)作为实验室制取氨气的反应原理.我需要用上面仪器中的 (填序号)来装配氨气发生装置(连接装置已经省略),我采用的收集方法是 .我选择的发生装置还可以用来制取 气体.
(4)某研究小组对用双氧水分解生成水和氧气的实验条件进行探究,完成了以下实验:
①往盛有5ml 5%H2O2溶液的试管中,伸入带火星的木条,木条不复燃.
②往盛有5ml w% H2O2溶液的试管中,加入a g MnO2,伸入带火星的木条,木条复燃.
③往盛有5ml w% H2O2溶液的试管中,加入a g Fe2O3,伸入带火星的木条,木条复燃.
④经检验,②③中反应后试管中仍分别含有a gMnO2和 ag Fe2O3
研究小组还对溶液浓度、催化剂的种类等实验条件进行探究.下表选取了部分实验数据:用足量等体积H2O2溶液制取相同体积O2所需要的时间
(1)我们已经学习过实验室制取O2、CO2、H2(Zn和稀硫酸反应)三种气体的反应原理、制取与收集方法.请你归纳出实验室制取气体反应的共同点
①需要加热 ②使用催化剂 ③没有气体参加反应 ④原料为纯净物 ⑤只生成一种气体
(2)下列是实验室常用的仪器

写出仪器名称:a是
(3)化学上可以通过多种反应制得NH3(极易溶于水,密度比空气小),例如
①2NH4Cl(固)+Ca(OH)2(固)
| ||
②NH4HCO3(固)
| ||
③CaO(固)+NH3.H2O(浓)═NH3↑+Ca(OH)2
我将选择反应
(4)某研究小组对用双氧水分解生成水和氧气的实验条件进行探究,完成了以下实验:
①往盛有5ml 5%H2O2溶液的试管中,伸入带火星的木条,木条不复燃.
②往盛有5ml w% H2O2溶液的试管中,加入a g MnO2,伸入带火星的木条,木条复燃.
③往盛有5ml w% H2O2溶液的试管中,加入a g Fe2O3,伸入带火星的木条,木条复燃.
④经检验,②③中反应后试管中仍分别含有a gMnO2和 ag Fe2O3
| 问题一:请你写出用双氧水和二氧化锰制氧气的化学反应方程式 问题二:MnO2和 Fe2O3在上述反应中的作用是 实验②④中的H2O2的浓度(w%)以 |
| 问题三:从左表中能得到哪些结论?(写出一条结论) |
| 浓度 时间(min) 条件 |
30%H2O2 | 15%H2O2 | 5%H2O2 |
| ag MnO2 | 0.2 | 0.8 | 2.0 |
| ag Fe2O3 | 0.7 | 9.0 | 16.0 |