题目内容
(相对原子质量:H-1,C-12,Ca-40)某同学粗略测定家里所用白醋中醋酸的质量分数(假设白醋中的酸都看作醋酸,醋酸的化学式为CH3COOH),在玻璃杯中加入100g碳酸钙粉末,再倒入200.0g白醋.反应停止后,碳酸钙有剩余,称得玻璃杯中的固体和液体总质量为297.8g.醋酸与碳酸钙反应的化学方程式为:2CH3COOH+CaCO3═(CH3COO)2Ca+CO2↑+H2O.若不考虑醋酸与水的挥发及二氧化碳的溶解,求:
①反应生成的二氧化碳质量为
②写出求溶液中醋酸质量(X)的比例式
=
=
;
③所测白醋中CH3COOH的质量分数
①反应生成的二氧化碳质量为
2.2
2.2
g;②写出求溶液中醋酸质量(X)的比例式
| 120 |
| X |
| 44 |
| 2.2g |
| 120 |
| X |
| 44 |
| 2.2g |
③所测白醋中CH3COOH的质量分数
3%
3%
.分析:因为醋酸和碳酸钙可以生成气体二氧化碳,所以反应后质量的减小值即为二氧化碳的质量,利用二氧化碳的质量结合该反应的方程式即可解决其它问题;
解答:解:反应生成二氧化碳的质量为:200.0g+100.0g-297.8g=2.2g;
设醋酸的质量为X,
2CH3COOH+CaCO3═(CH3COO)2Ca+CO2↑+H2O
120 44
X 2.2g
=
X=
=6.0g;
所测白醋中CH3COOH的质量分数为:
×100%=3%.
答:故答案为:2.2;
=
;3%;
设醋酸的质量为X,
2CH3COOH+CaCO3═(CH3COO)2Ca+CO2↑+H2O
120 44
X 2.2g
| 120 |
| X |
| 44 |
| 2.2g |
X=
| 120×2.2g |
| 44 |
所测白醋中CH3COOH的质量分数为:
| 6.0g |
| 200.0g |
答:故答案为:2.2;
| 120 |
| X |
| 44 |
| 2.2g |
点评:此题是根据化学方程式计算的考查题,解题的关键是利用质量守恒定律可知反应后质量减小值即为二氧化碳的质量;

练习册系列答案
相关题目
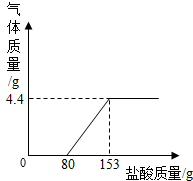 某造纸厂排放的废水中含有Na2CO3和NaOH.为了测定废水中Na2CO3的质量分数,取废水100g,逐滴滴加稀盐酸至过量,测得生成气体质量与所加稀盐酸质量关系如图所示.
某造纸厂排放的废水中含有Na2CO3和NaOH.为了测定废水中Na2CO3的质量分数,取废水100g,逐滴滴加稀盐酸至过量,测得生成气体质量与所加稀盐酸质量关系如图所示.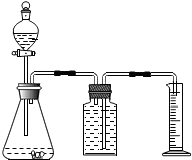 利用如图装置能制取氧气并测定所收集气体的体积.
利用如图装置能制取氧气并测定所收集气体的体积.