题目内容
在下列示意图表示的粒子中,属于原子的有(用序号填空,下同) ,属于阳离子的有 ,属于同种元素的有 ,属于稳定结构的有 .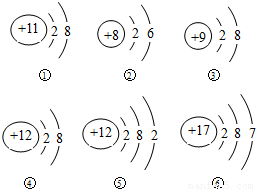
【答案】分析:①质子数为11,核外共有10个电子、最外层8个电子,带正电,为阳离子;
②质子数为8,核外共有8个电子、最外层有6个电子,质子数等于核外电子数,为不带电的原子;
③质子数为9,核外共有10个电子、电外层8个电子,电子数大于质子数,带负电,为阴离子;
④质子数为12,核外共有10个电子、最外层8个电子,电子数小于质子数,带正电,为阳离子;
⑤质子数为12,核外共有12个电子、最外层2个电子,质子数和核外电子数相等,为原子;
⑥质子数为17,核外共有17个电子、最外层7个电子,质子数和核外电子数相等,为原子.
解答:解:根据粒子结构示意图,②⑤⑥质子数与核外电子数相等,为原子;
故答:②⑤⑥;
①④质子数大于核外电子数,带正电,为阳离子;
故答:①④;
④⑤质子数相等,属于同种元素;
故答:④⑤;
①③④最外层电子数为8,属于稳定结构;
故答:①③④.
点评:原子,质子数=核外电子数;阴离子,质子数<核外电子数;阳离子,质子数>核外电子数.
②质子数为8,核外共有8个电子、最外层有6个电子,质子数等于核外电子数,为不带电的原子;
③质子数为9,核外共有10个电子、电外层8个电子,电子数大于质子数,带负电,为阴离子;
④质子数为12,核外共有10个电子、最外层8个电子,电子数小于质子数,带正电,为阳离子;
⑤质子数为12,核外共有12个电子、最外层2个电子,质子数和核外电子数相等,为原子;
⑥质子数为17,核外共有17个电子、最外层7个电子,质子数和核外电子数相等,为原子.
解答:解:根据粒子结构示意图,②⑤⑥质子数与核外电子数相等,为原子;
故答:②⑤⑥;
①④质子数大于核外电子数,带正电,为阳离子;
故答:①④;
④⑤质子数相等,属于同种元素;
故答:④⑤;
①③④最外层电子数为8,属于稳定结构;
故答:①③④.
点评:原子,质子数=核外电子数;阴离子,质子数<核外电子数;阳离子,质子数>核外电子数.

练习册系列答案
相关题目
煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。请回答下列问题:
(1)下列说法正确的是 。
A.煤是复杂的混合物,主要含碳元素
B.由煤加工成焦炭发生的是物理变化
C.家用“液化石油气”就是煤隔绝空气加热得到的产品
D.煤燃烧排放的二氧化硫、二氧化氮是形成酸雨的主要物质
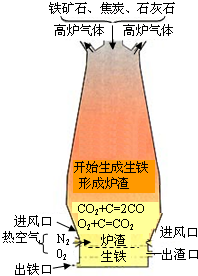
(2)煤的加工产品有很多用途,其中焦炭广泛应用于炼铁。
右图是高炉炼铁的示意图。请根据图例回答:

①焦炭在炼铁过程中的主要作用是 ;
②请用化学方程式表示炼铁的原理 ;
③高炉炼铁会产生大量的高炉气体,其主要成分是高浓度
的CO和氧化铁尘粒。请你对高炉气体的处理提出合理化的建议 。
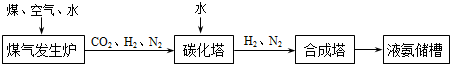
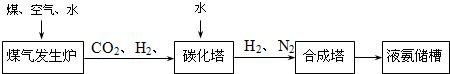
(3)化肥厂生产合成氨的原料是煤、空气、水。生产简要流程如下:
 |
煤气发生炉中主要反应:① C + O2 = CO2;② C + H2O = CO + H2。两个反应必须进行调控才能保持一定的炉温。判断:反应② (填“放出”或“吸收”)热量。
将合成的氨气部分通入碳化塔,既除去了二氧化碳又得到了化肥NH4HCO3, 试写出该反应的化学方程式 。
 (2010?白下区一模)煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.
(2010?白下区一模)煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.
