题目内容
(2002?吉林)完全中和20g氢氧化钠溶液,用去质量分数为25%的稀硫酸4.9g.求氢氧化钠溶液中溶质的质量分数.
分析:先根据稀硫酸的质量以及质量分数计算出硫酸溶质的质量;再根据硫酸质量以及硫酸与氢氧化钠反应的方程式即可求得参加反应的氢氧化钠的质量,即可求得氢氧化钠中溶质的质量分数.
解答:解:参加反应的稀硫酸中硫酸溶质的质量为:4.9g×25%=1.125g;
设参加反应的NaOH的质量为x
2NaOH+H2SO4═Na2SO4+2H2O
80 98
x 1.125g
=
x=1g;
则氢氧化钠中溶质的质量分数=
×100%=5%;
答:氢氧化钠中溶质的质量分数为5%.
设参加反应的NaOH的质量为x
2NaOH+H2SO4═Na2SO4+2H2O
80 98
x 1.125g
| 80 |
| x |
| 98 |
| 1.125g |
x=1g;
则氢氧化钠中溶质的质量分数=
| 1g |
| 20g |
答:氢氧化钠中溶质的质量分数为5%.
点评:本题考查了溶质质量分数的计算以及有关化学方程式的计算,属基础性知识考查题.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案
相关题目
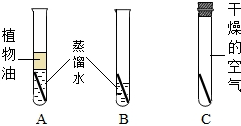 (2002?吉林)为了验证铁生锈的条件,某校化学兴趣小组的成员进行了如下图所示的实验.十天后,发现B中铁丝慢慢生锈,且水面处铁丝生锈较严重,而A、C中铁丝基本无变化.试根据图中的实验,回答下列问题:
(2002?吉林)为了验证铁生锈的条件,某校化学兴趣小组的成员进行了如下图所示的实验.十天后,发现B中铁丝慢慢生锈,且水面处铁丝生锈较严重,而A、C中铁丝基本无变化.试根据图中的实验,回答下列问题: