题目内容
将100gNa2CO3溶液和153.7gBaCl2溶液混合后,恰好完全反应,过滤,得滤液的质量为234g.求:
(1)反应后生成的沉淀的质量是________.
(2)过滤所得溶液中溶质的质量分数.
解:(1)反应后生成的沉淀的质量=100g+153.7g-234g=19.7g.故答案为:19.7g;
(2)设反应生成氯化钠的质量为x,
Na2CO3+BaCl2=2NaCl+BaCO3↓
117 197
x 19.7g
∴
∴x= =11.7g;
=11.7g;
过滤所得溶液中的溶质的质量分数为: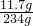 ×100%=5%.
×100%=5%.
答:过滤所得溶液中的溶质的质量分数为5%.
分析:(1)分析题意可知,滤液减少的质量就是生成沉淀的质量;
(2)利用碳酸钠与氯化钡反应的化学方程式和生成沉淀的质量,列出比例式,就可计算出反应生成氯化钠的质量,然后根据“溶质质量分数=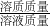 ×100%”计算即可.
×100%”计算即可.
点评:本题主要考查学生运用化学方程式和溶质质量分数公式综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.
(2)设反应生成氯化钠的质量为x,
Na2CO3+BaCl2=2NaCl+BaCO3↓
117 197
x 19.7g
∴

∴x=
 =11.7g;
=11.7g;过滤所得溶液中的溶质的质量分数为:
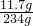 ×100%=5%.
×100%=5%.答:过滤所得溶液中的溶质的质量分数为5%.
分析:(1)分析题意可知,滤液减少的质量就是生成沉淀的质量;
(2)利用碳酸钠与氯化钡反应的化学方程式和生成沉淀的质量,列出比例式,就可计算出反应生成氯化钠的质量,然后根据“溶质质量分数=
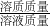 ×100%”计算即可.
×100%”计算即可.点评:本题主要考查学生运用化学方程式和溶质质量分数公式综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.

练习册系列答案
相关题目
实验室常用下列装置来制取气体:

(1)写出图中标号仪器的名称:a________ b________;c________;d________;
(2)装置B中使用仪器b具有的优点是________;若要检查该装置的气密性,应如何操作________.
(3)用双氧水和二氧化锰来制取氧气时,应选用的发生装置是________(填序号),该反应的符号表达式为:________,二氧化锰是该反应的________.
(4)实验室若用高锰酸钾来制备氧气,则应选用的发生装置是________(填序号),该反应的符号表达式为________;此反应中二氧化锰是作为________.要获得干燥的氧气,应选用的收集装置是________.
(5)上述两种方法都能用于实验室制备氧气,你认为其中相对较好的方法是________,其理由是________.
(6)实验室常用氯化铵固体与碱石灰固体共热来制取氨气.常温下氨气是一种无色、有刺激性气味的气体,密度比空气小,氨气极易溶于水.制取氨气反应的文字表达式:氯化铵+熟石灰 氯化钙+氨气+水.则制取并收集氨气,应该从上图中选择的发生装置是(________(填序号,下同),收集装置是________.
(6)“化学反应条件的控制是实验的灵魂”.某校化学兴趣小组在老师指导下,进行了“影响双氧水(过氧化氢溶液)分解因素”的探究实验.下表是该化学兴趣小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据:
用10mL H2O2溶液制取150mL氧气所需的时间(秒)
| 反应条件\浓度 | 30% H2O2 | 15% H2O2 | 10% H2O2 | 5% H2O2 |
| 无催化剂、不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
| 无催化剂、加热 | 360 | 480 | 540 | 720 |
| MnO2催化剂、加热 | 10 | 25 | 60 | 120 |
①该研究小组在设计方案时.考虑了浓度、________、________等因素对过氧化氢分解速率的影响.
②从上述影响过氧化氢分解速率的因素中任选一个,说明该因素对分解速率有何影响?________.
 ,下列说法不正确的是
,下列说法不正确的是