题目内容
 如图是A、B两种物质的溶解度曲线,请回答.
如图是A、B两种物质的溶解度曲线,请回答.(1)t3℃时,把46g固体A放入100g水中,充分溶解后可得到A的
不饱和
不饱和
溶液(填“饱和”或“不饱和”)(2)t1℃时,A、B两种物质溶解度的大小关系为A
<
<
B(填“>”、“<”或“=”,下同).(3)在其他条件不变的情况下,若把t1℃时A、B的饱和溶液分别升温至t2℃,此时两种溶液中溶质的质量分数的大小关系为A
<
<
B:(4)t1℃时,若要将甲物质的饱和溶液变为不饱和溶液,可采用的方法是
升温(或增加溶剂)
升温(或增加溶剂)
(写出一种即可)(5)若要从A中含有少量B的混合溶液中提纯A,可用的方法是
冷却热饱和溶液或降温结晶
冷却热饱和溶液或降温结晶
.分析:(1)据该温度下A的溶解度分析解答;
(2)据溶解度曲线可比较同一温度下不同物质的溶解度大小;
(3)据二者的溶解度随温度变化情况分析溶质的质量分数变化情况;
(4)饱和溶液变为不饱和溶液的一般方法是:升温或增加溶剂,结合A的溶解度受温度影响情况分析解答;
(5)据二者的溶解度受温度影响情况分析解答.
(2)据溶解度曲线可比较同一温度下不同物质的溶解度大小;
(3)据二者的溶解度随温度变化情况分析溶质的质量分数变化情况;
(4)饱和溶液变为不饱和溶液的一般方法是:升温或增加溶剂,结合A的溶解度受温度影响情况分析解答;
(5)据二者的溶解度受温度影响情况分析解答.
解答:解:(1)t3℃时A的溶解度是50g,所以把46g固体A放入100g水中,可充分溶解,得到A的不饱和溶液;
(2)t1℃时,A的溶解度小于B的溶解度;
(3)AB的溶解度均随温度的升高而增大,所以在其他条件不变的情况下,若把t1℃时A、B的饱和溶液分别升温至t2℃,二者均变为不饱和溶液,溶质和溶剂的质量不变,此时两种溶液中溶质的质量分数与升温前相同;据饱和时质量分数的计算式
×100%可知:溶解度大则溶质的质量分数大,由(2)可知:t1℃时,A的溶解度小于B的溶解度,所以升温后A的溶质质量分数小于B的溶质质量分数;
(4)A的溶解度随温度的升高而增大,所以t1℃时,若要将A物质的饱和溶液变为不饱和溶液,可采用升温或增加溶剂的方法;
(5)由图可知:A的溶解度受温度影响较大,B的溶解度也随温度的升高而增大,但没有A变化明显,所以要从A中含有少量B的混合溶液中提纯A,可用的方法降温结晶或冷却热饱和溶液的方法来提纯A;
故答案为:(1)不饱和;(2)<;(3)<;(4)升温(或增加溶剂);(5)冷却热饱和溶液或降温结晶.
(2)t1℃时,A的溶解度小于B的溶解度;
(3)AB的溶解度均随温度的升高而增大,所以在其他条件不变的情况下,若把t1℃时A、B的饱和溶液分别升温至t2℃,二者均变为不饱和溶液,溶质和溶剂的质量不变,此时两种溶液中溶质的质量分数与升温前相同;据饱和时质量分数的计算式
| 溶解度 |
| 溶解度+100g |
(4)A的溶解度随温度的升高而增大,所以t1℃时,若要将A物质的饱和溶液变为不饱和溶液,可采用升温或增加溶剂的方法;
(5)由图可知:A的溶解度受温度影响较大,B的溶解度也随温度的升高而增大,但没有A变化明显,所以要从A中含有少量B的混合溶液中提纯A,可用的方法降温结晶或冷却热饱和溶液的方法来提纯A;
故答案为:(1)不饱和;(2)<;(3)<;(4)升温(或增加溶剂);(5)冷却热饱和溶液或降温结晶.
点评:本题主要考查了固体溶解度曲线所表示的意义,及根据固体的溶解度曲线来解决相关的问题,从而培养学生分析问题、解决问题的能力.

练习册系列答案
相关题目
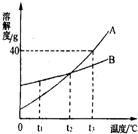 18、如图是A、B两种物质的溶解度曲线,请回答:
18、如图是A、B两种物质的溶解度曲线,请回答: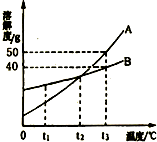 23、如图是A、B两种物质的溶解度曲线,请回答:
23、如图是A、B两种物质的溶解度曲线,请回答: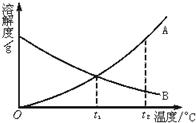
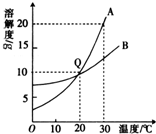 (2009?福建)溶液在日常生活和工农业生产中具有广泛用途.
(2009?福建)溶液在日常生活和工农业生产中具有广泛用途.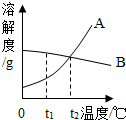 (2004?山西)如图是A、B两种物质的溶解曲线,试回答下列问题:
(2004?山西)如图是A、B两种物质的溶解曲线,试回答下列问题: