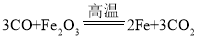题目内容
【题目】甲、乙、丙、丁分别为1-18号元素中的一种,且核电荷数依次增大,甲的单质是一种最理想的燃料,乙原子的最外层电子数是电子层数的3倍,丙的离子带一个单位的正电荷,丁与乙的原子最外层电子数相同。下列有关说法错误的是
A.甲和乙元素组成的物质分解能得到氧气
B.丙和丁的原子在化学反应中都容易失去电子
C.丙和丁原子的电子层数相同
D.丁的单质在乙的单质中燃烧,产生蓝紫色火焰
【答案】B
【解析】
甲的单质是一种最理想的燃料,则甲的单质是氢气,甲是氢元素;乙原子的最外层电子数是电子层数的3倍,则乙是氧元素,氧原子有2个电子层,最外层有6个电子,核外电子数示意图: ;丙的离子是钠离子(Na+)带一个单位的正电荷,丙是钠元素;丁与乙的原子最外层电子数相同,丁是硫元素,硫原子结构示意图:
;丙的离子是钠离子(Na+)带一个单位的正电荷,丙是钠元素;丁与乙的原子最外层电子数相同,丁是硫元素,硫原子结构示意图: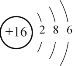 ;
;
A、氢元素和氧元素组成水,水通电分解能产生氢气和氧气;故选项正确,但不符合题意;
B、丁是硫原子,最外层有6个电子,在化学变化中容易得2个电子;故选项错误,但符合题意;
C、丙是钠元素,钠原子核外有三个电子层,丁是硫元素,硫原子核外有三个电子层,电子层数相等;故选项正确,但不符合题意;
D、硫在氧气中燃烧产生蓝紫色火焰;故选项正确,但不符合题意;
故选:B。

【题目】同学们在学习了焦炭还原氧化铁的反应后,联想到单质碳的一些化学性质,对反应后的气体成份产生了疑问,并对其气体成份进行了如下探究。
(猜想)①气体产物全部是CO2;②气体产物全部是_____;③气体产物是CO和CO2的混合物。
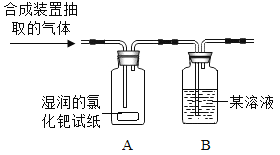
(查阅资料)CO气体能使湿润的黄色氯化钯试纸变蓝色。
(设计实验)根据各自的猜想,他们共同设计了如下图的实验装置进行探究。
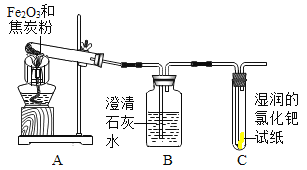
(现象与分析)
预期的现象 | 相应的结论 |
如果装置B中澄清石灰水变浑浊,装置C无明显现象; | 则猜想①成立; |
如果装置B中澄清石灰水变无明显变化,装置C_____; | 则猜想_____成立; |
如果装置B_____,装置C_____; | 则猜想_____成立。 |
(结论)根据实验结果猜想③成立,同学们的疑问是合理的。
(反思)
(1)同学们对CO产生的原因进行了首先Fe2O3与焦炭反应,生成的其中一种产物和焦炭又发生了化学反应,产生了CO;请你写出该化学反应涉及的两个化学方程式:_____、_____。
(2)根据上述实验,可以得出焦炭具有_____性。