题目内容
|

![]()
A B C D ![]() E F G
E F G
(1)标出仪器名称:①是 ;②是
(2)实验室用大理石和稀盐酸制取二氧化碳的化学方程式为_______________________;制取二氧化碳时应选择的发生装置和收集装置为 (填字母序号),选择此收集装置的理由是 ;若将产生的二氧化碳通入紫色石蕊试液,试液变 色,原因是 (用化学方程式表示)。
(3)实验室用一定质量的氯酸钾和二氧化锰制取氧气,通过排水量测定所收集到的氧气体积(装置选用A、F、G)。
①其中二氧化锰的作用是___________________________;
②若各装置的连接顺序是:a→b→c→d,F装置内导管(“b”或“c”)该怎样延伸?请在装置F中画出;
③根据氯酸钾的质量算出的氧气体积为理论值。如果实际测得氧气的体积大于理论值(水的体积测量准确),你认为原因可能是 。(任写一种情况)
(4)实验室用68g 2%的H2O2溶液和一定量的MnO2也能制取氧气,试计算完全反应后产生氧气的物质的量。(根据化学方程式列式计算)
(1)①长颈漏斗 ② 集气瓶
(2)CaCO3 +2HCl ![]() CaCl2+ H2O+ CO2↑、 BC 、二氧化碳密度比空气大
CaCl2+ H2O+ CO2↑、 BC 、二氧化碳密度比空气大
红色、H2O+ CO2 ![]() H2CO3
H2CO3
(3)①加快反应速度或催化作用 ②图略:b管短c管长
③未冷却到室温就读数
(4)(共3分)
双氧水溶液中溶质的质量为1.36g,物质的量为0.04mol(1分)
设0.04mol双氧水和二氧化锰产生xmol氧气
2H2O2 ![]() 2H2O+ O2↑
2H2O+ O2↑
2 1
0.04mol xmol
2/0.04 = 1/x (1分)
X=0.02mol (1分)
答:完全反应后生成氧气的物质的量为0.02mol

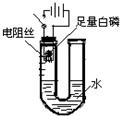 某研究性学习小组的同学为探究空气中氧气的体积分数,设计了如图所示装置.请你根据图示实验分析回答下列问题:
某研究性学习小组的同学为探究空气中氧气的体积分数,设计了如图所示装置.请你根据图示实验分析回答下列问题:
 20、如图是常见酸、碱、盐之间的相互转化关系.
20、如图是常见酸、碱、盐之间的相互转化关系.