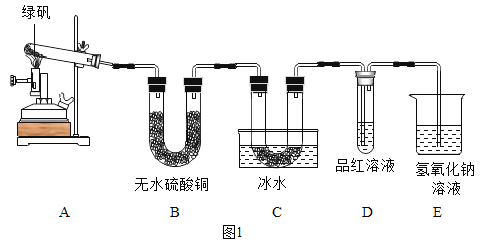
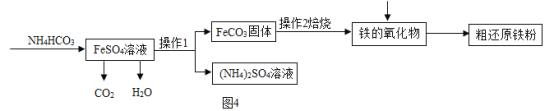
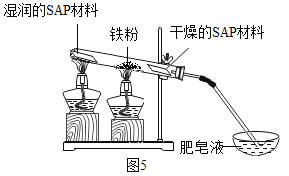
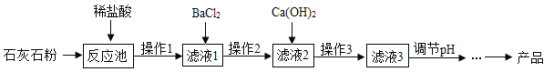
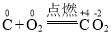题目内容
【题目】A、B、C为三种物质的溶解度曲线,如图所示,请根据图示信息回答下列问题。
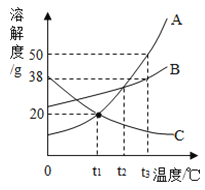
(1)A、B、C三种物质中可能是气体的是_______。
(2)t1℃时,将4gA物质放入10g水中,充分溶解,温度不变,所得溶液的质量为____g。
(3)将C的饱和溶液变为不饱和溶液,可采用的方法有___(填一种即可)
(4)t3℃时,要将等质量的A、B两种固体恰好配成饱和溶液,需要水的质量关系是A ___B。(填“>” “=”“<”)
(5)将t2℃时等质量的A、B、C三种物质的饱和溶液降温到t1℃,下列说法正确的是_____。
A 溶解度B>A>C
B 析出溶质的质量:A=C>B
C 溶质质量分数B>A>C
D 溶液质量C>B>A。
【答案】C 12 降温(或加溶剂合理均可) < CD
【解析】
(1)由于C物质的溶解度随温度的升高而减小,所以A、B、C三种物质中可能是气体的是C;
(2)t1℃时,A物质的溶解度是20g,所以将4gA物质放入10g水中,充分溶解,温度不变,只能溶解2g,所得溶液的质量为10+2g=12g;
(3)由于C物质的溶解度随温度的升高而减小,将C的饱和溶液变为不饱和溶液,可采用的方法有降温等。
(4)t3℃时,由于A的溶解度大于B,所以,要将等质量的A、B两种固体恰好配成饱和溶液,需要水的质量关系是A<B。
(5)将t2℃时等质量的A、B、C三种物质的饱和溶液降温到t1℃。
A.由溶解度曲线的意义可知,溶解度B>A=C,故A错误;
B.析出溶质的质量:A>B,C不析出晶体,故B错误;
C.由于在t1℃世B的溶解度大于A,A的溶解度大于在t2℃C的溶解度,所以溶质质量分数B>A>C,故C正确;
D.由上述分析可知,溶液质量C>B>A.,故D正确。
故答案为:(1)C;(2)12;(3)降温;(4)<;(5)CD。

 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案【题目】某研究性学习小组欲测定石灰石中碳酸钙的质量分数,采用的方法如下:取该石灰石样品5g,把60g稀盐酸分四次加入,实验过程所得数据如下表(已知石灰石样品中含有的杂质不溶于水,也不与稀盐酸反应)。
实验次数 | 1 | 2 | 3 | 4 |
加入稀盐酸的质量/g | 15 | 15 | 15 | 15 |
剩余固体的质量/g | 3.50 | 2.00 | 0.7 | 0.7 |
(1)石灰石样品中碳酸钙的质量分数是多少___________?
(2)求原60g稀盐酸中溶质质量分数___________。
【题目】一定条件下,密闭容器内发生某化学反应,测得反应前、后各物质的质量见如表。下列说法正确的是( )
物质的微观示意图 | 甲 | 乙 | 丙 | 丁 |
反应前的质量/g | 38 | 6 | 32 | 0 |
反应后的质量/g | 10 | 50 | x | 14 |
注:
A. 该反应属于置换反应
B. 甲、乙、丙、丁都可能是氧化物
C. 甲和丙的相对分子质量之比为14:15
D. 反应前物质的总质量等于反应后生成物的总质量