题目内容
工业上可以用高温煅烧石灰石的方法制取CO2,其反应的方程式为:CaCO3
CaO+CO2↑.
现将50g 含CaCO3质量分数为80%的石灰石样品(杂质不发生化学反应也不含钙),高温煅烧到不产生气体为止.
(1)产生CO2的质量.______
(2)生成氧化钙的质量.______
(3)所得固体中钙元素的质量分数.______.
| ||
现将50g 含CaCO3质量分数为80%的石灰石样品(杂质不发生化学反应也不含钙),高温煅烧到不产生气体为止.
(1)产生CO2的质量.______
(2)生成氧化钙的质量.______
(3)所得固体中钙元素的质量分数.______.
设产生CO2的质量为x.生成氧化钙的质量为y
CaCO3
CaO+CO2↑
100 56 44
50g×80% y x
=
=
x=17.6g,y=22.4g
所得固体中钙元素的质量分数为:
×100%=49.4%
答:(1)产生CO2的质量为17.6g;(2)生成氧化钙的质量为22.4g;(3)所得固体中钙元素的质量分数为49.4%.
CaCO3
| ||
100 56 44
50g×80% y x
| 100 |
| 50g×80% |
| 56 |
| y |
| 44 |
| x |
x=17.6g,y=22.4g
所得固体中钙元素的质量分数为:
50g×80%×
| ||
| 50g-17.6g |
答:(1)产生CO2的质量为17.6g;(2)生成氧化钙的质量为22.4g;(3)所得固体中钙元素的质量分数为49.4%.

练习册系列答案
 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案
相关题目
 CaO+CO2↑.
CaO+CO2↑.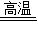 CaO+CO2↑.
CaO+CO2↑.