题目内容
 干冰是固态的二氧化碳,在常温下易升华,如图是干冰升华时的情景,根据图中信息,从“
干冰是固态的二氧化碳,在常温下易升华,如图是干冰升华时的情景,根据图中信息,从“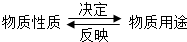 ”这一角度分析干冰具有的性质和用途.
”这一角度分析干冰具有的性质和用途.(1)干冰升华时
吸收
吸收
(填“吸收”或“放出”)大量热,因此可作致冷剂或用于人工降雨.(2)干冰转化成二氧化碳气体后能参与绿色植物的光合作用,绿色植物通过光合作用吸收二氧化碳,同时放出
氧气
氧气
(填名称).(3)将干冰转化成的二氧化碳气体通入紫色石蕊试液,可看到
变红
变红
的现象,原因是:(用化学方程式表示)CO2+H2O=H2CO3
CO2+H2O=H2CO3
,加热后可看到溶液由红色变成紫色
溶液由红色变成紫色
的现象.(4)大气中二氧化碳等气体的含量过高,容易造成“温室效应”.为了减缓“温室效应”,以下建议中合理的是
①②③
①②③
(填序号).①开发太阳能、水能、风能、地热等能源; ②减少化石燃料的使用;
③大量植树种草,禁止乱砍滥伐.
( 5 )近年来大气中二氧化碳含量不断上升的主要原因是
大量使用化石燃料
大量使用化石燃料
.( 6 )下列变化中,对维持大气中二氧化碳气体总量平衡至关重要的是
B
B
(填序号)A.CO2+H2O=H2CO3 B.6CO2+6H2O
| ||
C.CO2+C
| ||
分析:根据已有的知识进行分析,干冰升华能吸热,二氧化碳能与水反应生成碳酸,呈酸性,能使石蕊试液变红,碳酸不稳定,受热易分解生成二氧化碳和水,化石燃料的大量使用导致二氧化碳含量增高,在自然界中植物通过光合作用吸收二氧化碳.
解答:解:(1)干冰升华易吸热,可用于人工降雨,故填:吸热;
(2)植物通过光合作用吸收二氧化碳生成氧气,故填:氧气;
(3)二氧化碳能与水反应生成碳酸,碳酸呈酸性,能使石蕊试液变红,碳酸不稳定,受热易分解生成二氧化碳和水,酸性消失,故填:变红,CO2+H2O=H2CO3,溶液由红色变成紫色;
(4)①开发太阳能、水能、风能、地热等能源能减少二氧化碳的排放,有利于减缓温室效应,②减少化石燃料的使用能减少二氧化碳的排放,有利于减缓温室效应,③大量植树种草,禁止乱砍滥伐,能增加二氧化碳的吸收,有利于减缓温室效应,故填:①②③;
(5)近年来大气中二氧化碳含量不断上升的主要原因是化石燃料的大量使用,故填:大量使用化石燃料;
(6)自然界中维持二氧化碳平衡的主要反应是植物的光合作用,故填:B.
(2)植物通过光合作用吸收二氧化碳生成氧气,故填:氧气;
(3)二氧化碳能与水反应生成碳酸,碳酸呈酸性,能使石蕊试液变红,碳酸不稳定,受热易分解生成二氧化碳和水,酸性消失,故填:变红,CO2+H2O=H2CO3,溶液由红色变成紫色;
(4)①开发太阳能、水能、风能、地热等能源能减少二氧化碳的排放,有利于减缓温室效应,②减少化石燃料的使用能减少二氧化碳的排放,有利于减缓温室效应,③大量植树种草,禁止乱砍滥伐,能增加二氧化碳的吸收,有利于减缓温室效应,故填:①②③;
(5)近年来大气中二氧化碳含量不断上升的主要原因是化石燃料的大量使用,故填:大量使用化石燃料;
(6)自然界中维持二氧化碳平衡的主要反应是植物的光合作用,故填:B.
点评:本题考查了碳在自然界中的循环以及二氧化碳的性质,完成此题,可以依据已有的物质的性质进行.

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
 干冰是固态的二氧化碳,在常温下易升华,如图所示是干冰升华时的情景,根据图中信息,从“物质性质
干冰是固态的二氧化碳,在常温下易升华,如图所示是干冰升华时的情景,根据图中信息,从“物质性质 物质用途”这一角度分析干冰具有的性质和用途.
物质用途”这一角度分析干冰具有的性质和用途. 24、干冰是固态的二氧化碳,在常温下易升华,右图是干冰升华时的情景,根据图中信息,从“物质性质
24、干冰是固态的二氧化碳,在常温下易升华,右图是干冰升华时的情景,根据图中信息,从“物质性质 物质用途”这一角度
物质用途”这一角度 18、干冰是固态的二氧化碳,在常温下易升华,下图是干冰升华时的情景,根据图中信息,从“
18、干冰是固态的二氧化碳,在常温下易升华,下图是干冰升华时的情景,根据图中信息,从“ ”
” 干冰是固态的二氧化碳,在常温下易升华,右图是干冰升华时的情景,根据图中信息,从“物质性质
干冰是固态的二氧化碳,在常温下易升华,右图是干冰升华时的情景,根据图中信息,从“物质性质