题目内容
(4分)人类生产生活离不开钢铁。生铁和钢都是铁的合金。某同学将10 g铁的合金样品投入足量稀硫酸中,充分反应(合金中除铁外其他成分不与稀硫酸反应)。测得产生气体的质量为0.35 g。计算该合金中铁的质量分数。
解:设样品合金中铁的质量为m。
根据Fe+H2SO4===FeSO4+H2↑(1分)
56 2
m 0.35 g(1分)
则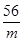 =
=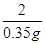
解得m=9.8 g(1分)
所以合金中铁的质量分数为 ×100%=98%。(1分)
×100%=98%。(1分)
答:该合金中铁的质量分数为98%。
根据Fe+H2SO4===FeSO4+H2↑(1分)
56 2
m 0.35 g(1分)
则
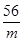 =
=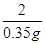
解得m=9.8 g(1分)
所以合金中铁的质量分数为
 ×100%=98%。(1分)
×100%=98%。(1分)答:该合金中铁的质量分数为98%。
根据生成的氢气的质量以及铁与稀硫酸反应的方程式,列比例式即可求得参加反应的铁的质量;最后根据某物质的质量分数=该物质的质量/样品的质量×100%即可求得该合金中铁的质量分数.
解:设样品合金中铁的质量为m.
根据Fe+H2SO4═FeSO4+H2↑
56 2
m 0.35 g(1分)
则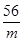 =
=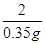
解得m=9.8 g(1分)
所以合金中铁的质量分数为 ×100%=98%。(1分)
×100%=98%。(1分)
答:该合金中铁的质量分数为98%。
解:设样品合金中铁的质量为m.
根据Fe+H2SO4═FeSO4+H2↑
56 2
m 0.35 g(1分)
则
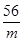 =
=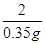
解得m=9.8 g(1分)
所以合金中铁的质量分数为
 ×100%=98%。(1分)
×100%=98%。(1分)答:该合金中铁的质量分数为98%。

练习册系列答案
相关题目
 C6H12O6 + 6O2。若消耗44 t二氧化碳,生成氧气的质量为多少?
C6H12O6 + 6O2。若消耗44 t二氧化碳,生成氧气的质量为多少?