题目内容
5.6g铁样品,溶解在足量的稀盐酸中生成0.2g氢气,下列说法正确的是
| A.该样品一定是纯净物 |
| B.该样品一定含有镁、铝两种杂质 |
| C.该样品一定是混合物 |
| D.该样品可能含有锌和镁两种杂质 |
D
假设5.6g全为纯的铁
Fe+2HCl=FeCl2+H2↑
56 2
5.6g 0.2g
现在氢气的质量为0.2g=0.2g,说明该样品是纯铁或杂质与HCl反应时的杂质特点是:同质量时有比铁生成的氢气多的金属也有比铁生成的氢气少的金属存在;故排除AC;
由于金属与酸的反应时生成氢气的质量=(金属的化合价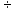 金属相对原子质量)×金属的质量,所以同质量的镁铝生成的氢气都比铁多,而同质量的锌比铁生成的氢气要少,所以B错误,D正确;
金属相对原子质量)×金属的质量,所以同质量的镁铝生成的氢气都比铁多,而同质量的锌比铁生成的氢气要少,所以B错误,D正确;
Fe+2HCl=FeCl2+H2↑
56 2
5.6g 0.2g
现在氢气的质量为0.2g=0.2g,说明该样品是纯铁或杂质与HCl反应时的杂质特点是:同质量时有比铁生成的氢气多的金属也有比铁生成的氢气少的金属存在;故排除AC;
由于金属与酸的反应时生成氢气的质量=(金属的化合价
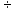 金属相对原子质量)×金属的质量,所以同质量的镁铝生成的氢气都比铁多,而同质量的锌比铁生成的氢气要少,所以B错误,D正确;
金属相对原子质量)×金属的质量,所以同质量的镁铝生成的氢气都比铁多,而同质量的锌比铁生成的氢气要少,所以B错误,D正确;
练习册系列答案
 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案
相关题目

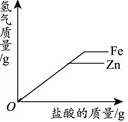
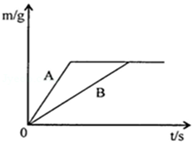
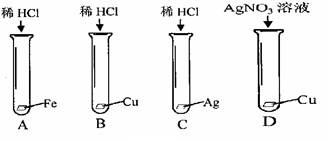
 3Mn+2Al2O3,该反应属于
3Mn+2Al2O3,该反应属于 