题目内容
【题目】某校兴趣小组取氯酸钾制取氧气,请按下面要求计算。
(1)取一定量氯酸钾和二氧化锰的混合物放入大试管中加热,加热至不再有气体产生为止,共收集到氧气4.8g,求混合物中氯酸钾的质量_________。
(2)若将(1)中氯酸钾平均分成两份,一份加入1g二氧化锰(曲线用a表示),另一份不加二氧化锰(曲线用b表示),分别放入试管中,同时、同温度加热至充分反应,请在上图画出产生O2的曲线_________。

(3)若将一定质量的氯酸钾加热,有关物质质量与反应时间的变化如表所示:
时间/min | t1 | t2 | t3 | t4 | t5 |
O2质量/g | 2.4 | 4.8 | 7.2 | 9.6 | 9.6 |
剩余固体质量/g | 22.1 | 19.7 | m | 14.9 | 14.9 |
其中m=____________;t3时剩余固体中含有的物质是_________________(填化学式)。
【答案】12.25g  17.3 KClO3、KCl
17.3 KClO3、KCl
【解析】
(1)设氯酸钾的质量x
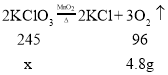
![]()
解得:x=12.25g
故填:12.25g
(2)若将(1)中氯酸钾平均分成两份,一份加入1g二氧化锰(曲线用a表示),另一份不加二氧化锰(曲线用b表示),分别放入试管中,同时、同温度加热,加入二氧化锰的a反应完需要的时间短,没有加二氧化锰的b反应完需要的时间长,不管加不加二氧化锰,最终生成氧气的质量都是2.4g,图像是 ;
;
故填: 。
。
(3)加热时间是t1时,生成氧气的质量是2.4g,剩余固体的质量是22.1g,反应前固体的质量是24.5g;
加热时间是t2时,生成氧气的质量是4.8g,剩余固体的质量是19.7g,反应前固体的质量是24.5g;
加热时间是t3时,生成氧气的质量是7.2g,剩余固体的质量是mg,反应前固体的质量是24.5g,m=24.5g-7.2g=17.3g;
加热时间是t4时,生成氧气的质量是9.6g,剩余固体的质量是14.9g,反应前固体的质量是24.5g;加热时间是t5时,生成氧气的质量是9.6g,剩余固体的质量是14.9g,反应前固体的质量是24.5g;
加热时间是t4和t5时,生成氧气的质量都是9.6g,剩余固体的质量都是14.9g,也就是加热时间是t4时,氯酸钾才完全反应,t3时,固体中的氯酸钾(KClO3)有剩余,氯酸钾分解又生成氯化钾(KCl)固体和氧气,所以剩余固体中有KClO3、KCl;
故填:17.3;KClO3、KCl。

 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案