题目内容
“黄铜”是铜锌合金,具有较机械性能,比纯铜耐腐蚀,街头许多“金色”饰品就是用它来制作的.现取20.0g某种黄铜投入154.7g某浓度的稀硫酸中,恰好完全反应后剩余的溶液和残余固体总质量为174.5g.请计算:
(1)产生氢气的质量为多少g?
(2)这种黄铜中铜的质量分数为多少?
(3)反应后溶液中溶质的质量分数是多少?
(1)产生氢气的质量为多少g?
(2)这种黄铜中铜的质量分数为多少?
(3)反应后溶液中溶质的质量分数是多少?
(1)产生氢气的质量=20.0g+154.7g-174.5g=0.2g
(2)设锌的质量为x;生成的硫酸锌的质量为y
Zn+H2SO4=ZnSO4+H2↑
65 161 2
x y 0.2g
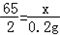
x=6.5g
铜的质量为:20.0g﹣6.5g=13.5g
黄铜中铜的质量分数为: 100%=67.5%
100%=67.5%
(3)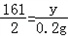
y=16.1g
反应后溶液的质量为:174.5g﹣13.5g=161g
反应后溶液中溶质的质量分数为: ×100%=10%
×100%=10%
答:(1)产生氢气的质量为0.2g;(2)这种黄铜中铜的质量分数为67.5%;(3)反应后溶液中溶质的质量分数是10%.
(2)设锌的质量为x;生成的硫酸锌的质量为y
Zn+H2SO4=ZnSO4+H2↑
65 161 2
x y 0.2g
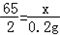
x=6.5g
铜的质量为:20.0g﹣6.5g=13.5g
黄铜中铜的质量分数为:
 100%=67.5%
100%=67.5%(3)
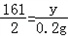
y=16.1g
反应后溶液的质量为:174.5g﹣13.5g=161g
反应后溶液中溶质的质量分数为:
 ×100%=10%
×100%=10%答:(1)产生氢气的质量为0.2g;(2)这种黄铜中铜的质量分数为67.5%;(3)反应后溶液中溶质的质量分数是10%.

练习册系列答案
相关题目
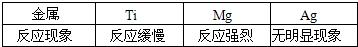
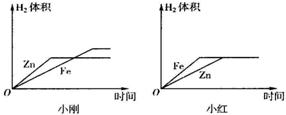
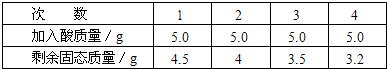
 用化学式表示下列物质
用化学式表示下列物质