题目内容
某同学称取一定量的表面有铜绿的铜粉,用敞口耐高温容器盛装,在空气中充分加热[铜绿受热分解的化学方程式为:
Cu2(OH)2CO3
CuO+H2O+CO2↑]冷却后再称量该容器中固体物质的质量,结果是( )
Cu2(OH)2CO3
| ||
| A、质量减小 |
| B、质量增大 |
| C、质量不变 |
| D、以上三种情况均有可能 |
分析:利用铜绿加热反应的方程式是:Cu2(OH)2CO3
2CuO+H2O+CO2↑固体质量减少,而铜加热的反应是:2Cu+O2
2CuO固体质量增加的知识解决.
| ||
| ||
解答:解:因为铜绿加热反应的方程式是:Cu2(OH)2CO3
2CuO+H2O+CO2↑反应后固体质量减少,而铜加热的反应是:2Cu+O2
2CuO反应后固体质量增加,因为两者的质量不确定,所以加热后固体的质量的变化无法判断.
故选D.
| ||
| ||
故选D.
点评:此题是对物质性质的考查题,解题的关键是对反应后质量变化的分析,属于基础性知识考查题.

练习册系列答案
相关题目
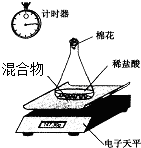 某变质的NaOH固体中含有Na2CO3.老师安排第一小组做除去NaOH溶液中Na2CO3的实验.第二小组同学做测定该固体混合物中Na2CO3质量分数的实验.
某变质的NaOH固体中含有Na2CO3.老师安排第一小组做除去NaOH溶液中Na2CO3的实验.第二小组同学做测定该固体混合物中Na2CO3质量分数的实验.Ⅰ、第一小组的同学取一定量的该固体溶于水,得到混合溶液,为了除去溶液中的Na2CO3杂质,甲、乙、丙、丁四位同学分别选择下列试剂进行实验.其中合理的是
甲:适量稀盐酸乙:过量KOH溶液丙:适量Ca(OH)2溶液丁:适量CaCl2溶液.
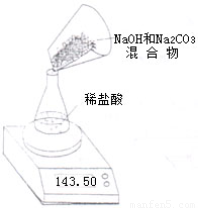
Ⅱ、第二小组利用电子天平测定NaOH和Na2CO3的混合物中Na2CO3的质量分数(装置见下图,不考虑水与氯化氢的挥发),实验数据如表:
| 称 量 项 目 | 质量(g) |
| NaOH和Na2CO3的混合物 | 10.00 |
| 锥形瓶+稀盐酸质量(过量) | 141.20 |
| 锥形瓶+稀盐酸质量+全部NaOH和Na2CO3的混合物(反应开始后15秒) | 149.20 |
| 锥形瓶+稀盐酸质量+全部NaOH和Na2CO3的混合物(反应开始后35秒) | 149.00 |
| 锥形瓶+稀盐酸质量+全部NaOH和Na2CO3的混合物(反应开始后55秒) | 149.00 |
(2)试通过分析计算出混合物中Na2CO3的质量分数为多少.
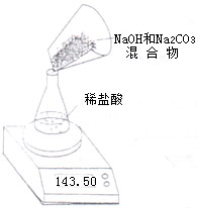 某NaOH固体中含有Na2CO3.老师安排第一小组做除去NaOH溶液中Na2CO3的实验.第二、第三小组同学做测定该固体混合物中Na2CO3质量分数的实验.
某NaOH固体中含有Na2CO3.老师安排第一小组做除去NaOH溶液中Na2CO3的实验.第二、第三小组同学做测定该固体混合物中Na2CO3质量分数的实验.Ⅰ.第一小组的同学取一定量的该固体溶于水,得到混合溶液,为了除去溶液中的
Na2CO3杂质,甲、乙、丙、丁四位同学分别选择下列试剂进行实验.其中,不合理的是
甲:适量稀盐酸.乙:过量KOH溶液.丙:适量Ba(OH)2溶液.丁:适量CaCl2溶液.
Ⅱ.第二小组利用左下图装置测定NaOH和Na2CO3的混合物中Na2CO3的质量分数,用电子天平称量数据如下表:
| 称 量 项 目 | 质量(g) |
| NaOH和Na2CO3的混合物 | 9.30 |
| 锥形瓶质量 | 41.20 |
| 锥形瓶+稀盐酸质量(过量) | 141.20 |
| 锥形瓶+稀盐酸质量+全部NaOH和Na2CO3的混合物后,第一次称量的质量 | 148.50 |
| 锥形瓶+稀盐酸质量+全部NaOH和Na2CO3的混合物后,第二次称量的质量 | 148.30 |
| 锥形瓶+稀盐酸质量+全部NaOH和Na2CO3的混合物后,第三次称量的质量 | 148.30 |
(2)混合物中Na2CO3的质量分数为
Ⅲ.第三组选用另一种方案测定NaOH和Na2CO3的混合物(mg)中Na2CO3的质量分数,其操作流程如下:
固体混合物
| 水 |
| ||
| 操作B |
| ||
| 称量 |
(1)A是
(2)B操作的名称是
(3)计算混合物中Na2CO3的质量分数.(写出计算步骤)
某NaOH固体中含有Na2CO3.老师安排第一小组做除去NaOH溶液中Na2CO3的实验.第二、第三小组同学做测定该固体混合物中Na2CO3质量分数的实验.
Ⅰ.第一小组的同学取一定量的该固体溶于水,得到混合溶液,为了除去溶液中的
Na2CO3杂质,甲、乙、丙、丁四位同学分别选择下列试剂进行实验.其中,不合理的是______.
甲:适量稀盐酸.乙:过量KOH溶液.丙:适量Ba(OH)2溶液.丁:适量CaCl2溶液.
Ⅱ.第二小组利用左下图装置测定NaOH和Na2CO3的混合物中Na2CO3的质量分数,用电子天平称量数据如下表:
(1)写出固体混合物与盐酸发生化学反应的化学方程式:______.
(2)混合物中Na2CO3的质量分数为______.
Ⅲ.第三组选用另一种方案测定NaOH和Na2CO3的混合物(mg)中Na2CO3的质量分数,其操作流程如下:
固体混合物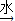 溶液
溶液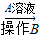 BaCO3
BaCO3 a g
a g
(1)A是______(填化学式).该实验要求加入的A溶液必须过量,检查A溶液已经过量的方法是______.
(2)B操作的名称是______.该操作需要的玻璃仪器有______.
(3)计算混合物中Na2CO3的质量分数.(写出计算步骤)
Ⅰ.第一小组的同学取一定量的该固体溶于水,得到混合溶液,为了除去溶液中的
Na2CO3杂质,甲、乙、丙、丁四位同学分别选择下列试剂进行实验.其中,不合理的是______.
甲:适量稀盐酸.乙:过量KOH溶液.丙:适量Ba(OH)2溶液.丁:适量CaCl2溶液.
Ⅱ.第二小组利用左下图装置测定NaOH和Na2CO3的混合物中Na2CO3的质量分数,用电子天平称量数据如下表:
| 称 量 项 目 | 质量(g) |
| NaOH和Na2CO3的混合物 | 9.30 |
| 锥形瓶质量 | 41.20 |
| 锥形瓶+稀盐酸质量(过量) | 141.20 |
| 锥形瓶+稀盐酸质量+全部NaOH和Na2CO3的混合物后,第一次称量的质量 | 148.50 |
| 锥形瓶+稀盐酸质量+全部NaOH和Na2CO3的混合物后,第二次称量的质量 | 148.30 |
| 锥形瓶+稀盐酸质量+全部NaOH和Na2CO3的混合物后,第三次称量的质量 | 148.30 |
(2)混合物中Na2CO3的质量分数为______.
Ⅲ.第三组选用另一种方案测定NaOH和Na2CO3的混合物(mg)中Na2CO3的质量分数,其操作流程如下:
固体混合物
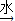 溶液
溶液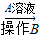 BaCO3
BaCO3 a g
a g(1)A是______(填化学式).该实验要求加入的A溶液必须过量,检查A溶液已经过量的方法是______.
(2)B操作的名称是______.该操作需要的玻璃仪器有______.
(3)计算混合物中Na2CO3的质量分数.(写出计算步骤)

(2008?玄武区一模)某变质的NaOH固体中含有Na2CO3.老师安排第一小组做除去NaOH溶液中Na2CO3的实验.第二小组同学做测定该固体混合物中Na2CO3质量分数的实验.
Ⅰ、第一小组的同学取一定量的该固体溶于水,得到混合溶液,为了除去溶液中的Na2CO3杂质,甲、乙、丙、丁四位同学分别选择下列试剂进行实验.其中合理的是______.
甲:适量稀盐酸乙:过量KOH溶液丙:适量Ca(OH)2溶液丁:适量CaCl2溶液.
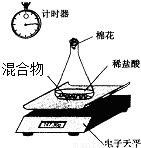
Ⅱ、第二小组利用电子天平测定NaOH和Na2CO3的混合物中Na2CO3的质量分数(装置见下图,不考虑水与氯化氢的挥发),实验数据如表:
(1)写出固体混合物与盐酸发生化学反应的化学方程式:______、______.
(2)试通过分析计算出混合物中Na2CO3的质量分数为多少.

Ⅰ、第一小组的同学取一定量的该固体溶于水,得到混合溶液,为了除去溶液中的Na2CO3杂质,甲、乙、丙、丁四位同学分别选择下列试剂进行实验.其中合理的是______.
甲:适量稀盐酸乙:过量KOH溶液丙:适量Ca(OH)2溶液丁:适量CaCl2溶液.
Ⅱ、第二小组利用电子天平测定NaOH和Na2CO3的混合物中Na2CO3的质量分数(装置见下图,不考虑水与氯化氢的挥发),实验数据如表:
| 称 量 项 目 | 质量(g) |
| NaOH和Na2CO3的混合物 | 10.00 |
| 锥形瓶+稀盐酸质量(过量) | 141.20 |
| 锥形瓶+稀盐酸质量+全部NaOH和Na2CO3的混合物(反应开始后15秒) | 149.20 |
| 锥形瓶+稀盐酸质量+全部NaOH和Na2CO3的混合物(反应开始后35秒) | 149.00 |
| 锥形瓶+稀盐酸质量+全部NaOH和Na2CO3的混合物(反应开始后55秒) | 149.00 |
(2)试通过分析计算出混合物中Na2CO3的质量分数为多少.

(2008?玄武区一模)某变质的NaOH固体中含有Na2CO3.老师安排第一小组做除去NaOH溶液中Na2CO3的实验.第二小组同学做测定该固体混合物中Na2CO3质量分数的实验.
Ⅰ、第一小组的同学取一定量的该固体溶于水,得到混合溶液,为了除去溶液中的Na2CO3杂质,甲、乙、丙、丁四位同学分别选择下列试剂进行实验.其中合理的是______.
甲:适量稀盐酸乙:过量KOH溶液丙:适量Ca(OH)2溶液丁:适量CaCl2溶液.
Ⅱ、第二小组利用电子天平测定NaOH和Na2CO3的混合物中Na2CO3的质量分数(装置见下图,不考虑水与氯化氢的挥发),实验数据如表:
(1)写出固体混合物与盐酸发生化学反应的化学方程式:______、______.
(2)试通过分析计算出混合物中Na2CO3的质量分数为多少.
Ⅰ、第一小组的同学取一定量的该固体溶于水,得到混合溶液,为了除去溶液中的Na2CO3杂质,甲、乙、丙、丁四位同学分别选择下列试剂进行实验.其中合理的是______.
甲:适量稀盐酸乙:过量KOH溶液丙:适量Ca(OH)2溶液丁:适量CaCl2溶液.
Ⅱ、第二小组利用电子天平测定NaOH和Na2CO3的混合物中Na2CO3的质量分数(装置见下图,不考虑水与氯化氢的挥发),实验数据如表:
| 称 量 项 目 | 质量(g) |
| NaOH和Na2CO3的混合物 | 10.00 |
| 锥形瓶+稀盐酸质量(过量) | 141.20 |
| 锥形瓶+稀盐酸质量+全部NaOH和Na2CO3的混合物(反应开始后15秒) | 149.20 |
| 锥形瓶+稀盐酸质量+全部NaOH和Na2CO3的混合物(反应开始后35秒) | 149.00 |
| 锥形瓶+稀盐酸质量+全部NaOH和Na2CO3的混合物(反应开始后55秒) | 149.00 |
(2)试通过分析计算出混合物中Na2CO3的质量分数为多少.
