题目内容
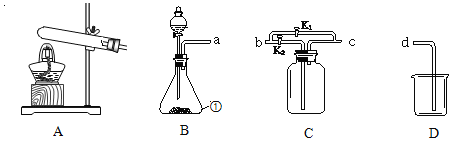
【题目】某学习小组做镁条在空气中燃烧实验时,发现生成物中有黑色固体.针对这一现象,他们猜想可能是镁与N2或CO2反应生成黑色固体。针对猜想他们开展了如下探究活动.有同学设计了以下三种装置来获得氮气。小王通过查资料得到以下信息:SO2可以和澄清石灰水发生部分反应,P2O5极易溶于水生成一种酸,CO2可溶于水。请你帮忙完成以下任务
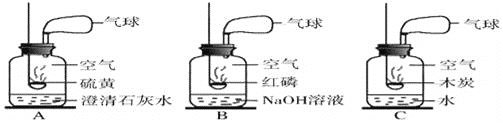
【实验一】镁带与氮气的反应
(1)以上是获取氮气的方法及装置,其中得到氮气较纯的是____________(填字母)
(2)燃烧镁带,观察现象
将镁带打磨光亮,点燃,伸入盛N2的集气瓶中,瓶内壁附着一层淡黄色的固体。
(3)实验结论:镁与氮气在点燃的条件下发生化合反应,生成淡黄色的氮化镁.(氮的化合价为-3)该反应的化学方程式是:___________。
(4)实验反思:空气中N2的含量远大于O2的含量,而镁条在空气中燃烧生成的氧化镁却远多于氮化镁。原因是____________
【实验二】镁带与二氧化碳的反应
将燃着的镁带伸入盛CO2的集气瓶中,镁带剧烈燃烧,瓶内产生氧化镁和一种黑色固体单质,该黑色物质是____________(写出化学式,下同)
【探究结论】
镁在空气中燃烧产生的黑色固体是镁与空气中____________反应产生的.
【答案】 B 3Mg+N2![]() Mg3N2 氧气比氮气活泼 C CO2
Mg3N2 氧气比氮气活泼 C CO2
【解析】【实验一】镁带与氮气的反应。(1)得到氮气较纯的方法及装置是B,红磷燃烧产物是固体五氧化二磷。(2)燃烧镁带,观察现象。将镁带打磨光亮,点燃,伸入盛N2的集气瓶中,瓶内壁附着一层淡黄色的固体。(3)实验结论:镁与氮气在点燃的条件下发生化合反应,生成淡黄色的氮化镁。该反应的化学方程式是:3Mg+N2![]() Mg3N2。(4)实验反思:空气中N2的含量远大于O2的含量,而镁条在空气中燃烧生成的氧化镁却远多于氮化镁。原因是氧气比氮气活泼,镁首先与氧气反应。【实验二】镁带与二氧化碳的反应。将燃着的镁带伸入盛CO2的集气瓶中,镁带剧烈燃烧,瓶内产生氧化镁和一种黑色固体单质,根据质量守恒定律,该黑色物质是C。【探究结论】镁在空气中燃烧产生的黑色固体是镁与空气中CO2
Mg3N2。(4)实验反思:空气中N2的含量远大于O2的含量,而镁条在空气中燃烧生成的氧化镁却远多于氮化镁。原因是氧气比氮气活泼,镁首先与氧气反应。【实验二】镁带与二氧化碳的反应。将燃着的镁带伸入盛CO2的集气瓶中,镁带剧烈燃烧,瓶内产生氧化镁和一种黑色固体单质,根据质量守恒定律,该黑色物质是C。【探究结论】镁在空气中燃烧产生的黑色固体是镁与空气中CO2
反应产生的。
点睛∶镁与氧气,氮气和二氧化碳均能发生化学反应。

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案【题目】钛(Ti)因为具有许多神奇的性能而越来越引起人们的关注.金属钛被称为铁和铝之后崛起的“第三种金属.工业上用钛铁矿(主要成分FeTiO3)制备金属钛的一种工艺流程如图所示。
【查阅资料】钛、镁在高温下与空气中的氧气、二氧化碳等反应.
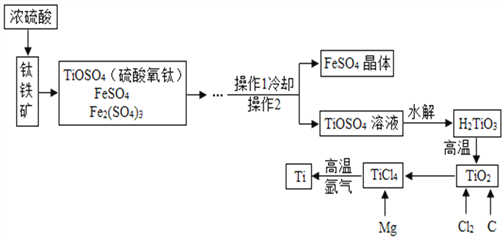
(1)操作2的名称是________.
(2)工艺流程中,水解属于________变化.(填“物理”或“化学”)
(3)工业上常在高温和氩气氛围中,用金属镁Mg与TiCl4反应生成Ti和氯化镁的化学方程式为________________________________,氩气的作用是______________________。
(4)某化学兴趣小组对Mg、Ti、Ag的金属活动性顺序进行探究
【实验设计】同温下,取大小相同的这三种金属薄片,分别投入等体积、等质量分数的足量稀硫酸中,观察现象.根据如表中的实验现象填空:
Ti | Mg | Ag | |
实验现象 | 产生气泡速度缓慢 | 产生气泡速度快 | 无任何现象 |
【结论】三种金属的活动性顺序________,写出镁与稀硫酸反应的化学方程式______________________。