题目内容
(6分)金属材料在国防建设中起着重要的作用。

(1)改装前的“辽宁舰”锈迹斑斑,钢铁锈蚀主要是铁与 作用的结果。工业生产中常用稀盐酸除去铁制品表面的铁锈,该反应的化学方程式为 。
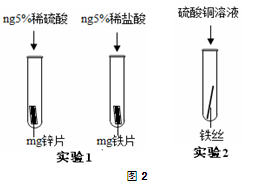
(2)为避免轮船的钢质外壳被腐蚀,通常在轮船外壳上镶嵌比铁活动性强的金属。小明为探究锌、铁、铜三种金属的活动性顺序,设计了如图2所示的两个实验:
①实验1中,小明以“金属表面产生气泡的快慢”为标准来判断锌、铁的活动性强弱,有同学认为不合理,理由是 。
②通过实验2,可证明铁的活动性比铜强,反应的化学方程式是 。


(1)改装前的“辽宁舰”锈迹斑斑,钢铁锈蚀主要是铁与 作用的结果。工业生产中常用稀盐酸除去铁制品表面的铁锈,该反应的化学方程式为 。
(2)为避免轮船的钢质外壳被腐蚀,通常在轮船外壳上镶嵌比铁活动性强的金属。小明为探究锌、铁、铜三种金属的活动性顺序,设计了如图2所示的两个实验:
①实验1中,小明以“金属表面产生气泡的快慢”为标准来判断锌、铁的活动性强弱,有同学认为不合理,理由是 。
②通过实验2,可证明铁的活动性比铜强,反应的化学方程式是 。
(1)氧气(或空气)、水 Fe2O3+6HCl 2FeCl3+3H2O (2)①酸不同 ② Fe+CuSO4 FeSO4+Cu
试题分析:(1) 钢铁锈蚀主要是铁与)氧气(或空气)、水作用的结果。工业生产中常用稀盐酸除去铁制品表面的铁锈,该反应的化学方程式为Fe2O3+6HCl

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
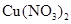 的混合溶液中,使其充分反应后过滤,得到固体和滤液。下列对滤液组成的猜测中合理的是( )
的混合溶液中,使其充分反应后过滤,得到固体和滤液。下列对滤液组成的猜测中合理的是( )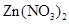 溶液
溶液 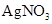 和
和