题目内容
【题目】木炭粉还原氧化铜实验后的混合粉末中含有铜、氧化铜、少量木炭粉,实验室从该混合粉末中回收铜的方案如下。
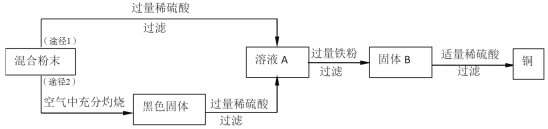
请根据流程图,回答下列问题:
(1)稀硫酸的溶质是H2SO4,其中硫元素的化合价为_________。
(2)固体B所含的物质是________(填物质化学式),溶液A加入过量铁粉的化学方程式是_________(任写一个)。
(3)检验得到的铜是否含铁粉的的操作是__________。
(4)途径2与途径1比较,途径2优点是__________。
【答案】+6 Fe、Cu Fe+H2SO4![]() FeSO4+H2↑(或Fe+CuSO4
FeSO4+H2↑(或Fe+CuSO4![]() FeSO4+Cu) 取得到的铜于试管中,加入稀盐酸(或取得到的铜,用磁铁吸引,操作合理就得分) 得到更多的铜(或使混合物中的铜元素全部回收)
FeSO4+Cu) 取得到的铜于试管中,加入稀盐酸(或取得到的铜,用磁铁吸引,操作合理就得分) 得到更多的铜(或使混合物中的铜元素全部回收)
【解析】
(1)H2SO4中,H的化合价为+1,O的化合价为﹣2价,根据化合物中元素的化合价代数和为0的原则,设硫的化合价为x,则+1×2+x+(-2)×4=0,x=+6,所以硫的化合价为+6价,故填+6。
(2)根据反应流程及反应物和生成物分析,固体B所含的物质是被铁置换出的铜和剩余的铁,其化学式为:Fe、Cu,故填Fe、Cu;
氧化铜与硫酸反应生成硫酸铜和水,过滤后的滤液A中含有硫酸铜和剩余的稀硫酸,加入铁粉,硫酸铜和铁粉反应生成硫酸亚铁和铜,化学方程式为:Fe+CuSO4![]() FeSO4+Cu,硫酸与铁反应生成硫酸亚铁和氢气,反应的化学方程式为:Fe+H2SO4
FeSO4+Cu,硫酸与铁反应生成硫酸亚铁和氢气,反应的化学方程式为:Fe+H2SO4![]() FeSO4+H2↑,故填 Fe+H2SO4
FeSO4+H2↑,故填 Fe+H2SO4![]() FeSO4+H2↑(或Fe+CuSO4
FeSO4+H2↑(或Fe+CuSO4![]() FeSO4+Cu)。
FeSO4+Cu)。
(3)检验得到的铜是否含铁粉的操作是:取少量固体滴入稀盐酸,观察是否有气泡产生,有气泡产生即为有铁粉,否则没有;或取得到的铜,用磁铁吸引,故填取得到的铜于试管中,加入稀盐酸(或取得到的铜,用磁铁吸引,操作合理就得分)。
(4)途径Ⅱ与途径Ⅰ比较,Ⅱ的优点是直接除去木炭粉,简化了实验步骤,同时混合物中的铜加热后可以转化为氧化铜,且氧化铜可以与稀硫酸反应生成硫酸铜,从而使最终制得的铜的量变多,故填得到更多的铜(或使混合物中的铜元素全部回收)。

 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案【题目】下列选项中方程式和分析均完全正确的是
选项 | 化学方程式 | 分析 |
A. | S+O2 | 该反应的现象是产生二氧化硫气体 |
B. | Mg + O2==2MgO | 该反应可以在常温下进行,说明镁的化学性质比较活泼 |
C. | 2H2O2 | 该反应可以用于氢气的制取 |
D. | Fe2O3+3CO | 该反应可用于提取铁矿石中的铁 |
A. A B. B C. C D. D