题目内容
将4.4g二氧化碳气体通入200g氢氧化钠溶液中,恰好完全反应.请通过计算回答下列问题:
(1)反应后所得溶液的质量;
(2)反应后所得溶液的质量分数;
(3)所得溶液中钠元素的质量分数.
解:(1)反应后所得溶液的质量为:4.4g+200g=204.4g
(2)设生成碳酸钠的质量为x
2NaOH+CO2=Na2CO3+H2O
. 44 106
. 4.4g x
44:106=4.4g:x
解之得x=10.6g
反应后所得溶液的质量分数=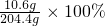 ≈5.2%
≈5.2%
(3)10.6g碳酸钠中Na元素质量=10.6g×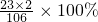 =4.6g
=4.6g
所得溶液中钠元素的质量分数=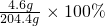 ≈2.3%
≈2.3%
答:(1)反应后所得溶液的质量为204.4g;
(2)反应后所得溶液的质量分数为5.2%;
(3)所得溶液中钠元素的质量分数约为2.3%.
分析:200g为氢氧化钠溶液的质量,不是纯净物氢氧化钠的质量,所以不能使用该质量利用化学方程式进行计算;
反应的生成物中无气体或沉淀生成,根据质量守恒定律,反应后所得溶液的质量=氢氧化钠溶液质量+二氧化碳质量.
点评:所得溶液为碳酸钠溶液,溶液中钠元素为碳酸钠中所含的钠元素,则根据钠元素质量与溶液质量的比即为所得溶液中钠元素的质量分数.
(2)设生成碳酸钠的质量为x
2NaOH+CO2=Na2CO3+H2O
. 44 106
. 4.4g x
44:106=4.4g:x
解之得x=10.6g
反应后所得溶液的质量分数=
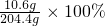 ≈5.2%
≈5.2%(3)10.6g碳酸钠中Na元素质量=10.6g×
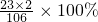 =4.6g
=4.6g所得溶液中钠元素的质量分数=
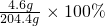 ≈2.3%
≈2.3%答:(1)反应后所得溶液的质量为204.4g;
(2)反应后所得溶液的质量分数为5.2%;
(3)所得溶液中钠元素的质量分数约为2.3%.
分析:200g为氢氧化钠溶液的质量,不是纯净物氢氧化钠的质量,所以不能使用该质量利用化学方程式进行计算;
反应的生成物中无气体或沉淀生成,根据质量守恒定律,反应后所得溶液的质量=氢氧化钠溶液质量+二氧化碳质量.
点评:所得溶液为碳酸钠溶液,溶液中钠元素为碳酸钠中所含的钠元素,则根据钠元素质量与溶液质量的比即为所得溶液中钠元素的质量分数.

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案
相关题目
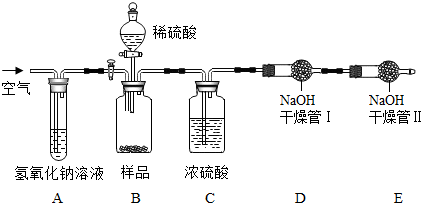 做菜用的一种嫩肉粉,其主要成分是碳酸氢钠.小明发现将拌了嫩肉粉的肉类放到锅中并加入食醋等调料烧煮时产生了大量气泡.他对此颇感兴趣,决定对其进行探究.
做菜用的一种嫩肉粉,其主要成分是碳酸氢钠.小明发现将拌了嫩肉粉的肉类放到锅中并加入食醋等调料烧煮时产生了大量气泡.他对此颇感兴趣,决定对其进行探究.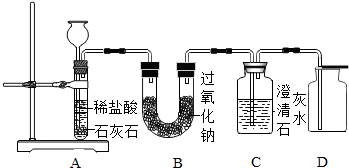 (2012?息县二模)金属过氧化物等可作宇宙飞船或潜水艇中的氧气再生剂,如:过氧化钠(Na2O2)在常温下能与人呼出的二氧化碳反应生成氧气,化学方程式为:2Na2O2+2CO2═2Na2CO3+O2.为了验证该反应中氧气的产生,某兴趣小组的同学设计了如图所示的实验.
(2012?息县二模)金属过氧化物等可作宇宙飞船或潜水艇中的氧气再生剂,如:过氧化钠(Na2O2)在常温下能与人呼出的二氧化碳反应生成氧气,化学方程式为:2Na2O2+2CO2═2Na2CO3+O2.为了验证该反应中氧气的产生,某兴趣小组的同学设计了如图所示的实验.