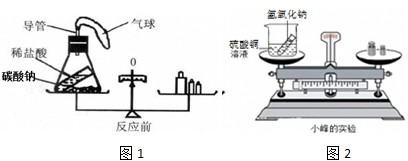
题目内容
在天平两托盘上的小烧杯里,各注入同浓度等质量的稀盐酸后,调整天平至平衡,这时指针指向标尺的“0”处,然后在左盘烧杯里加入m克锌粒,在右盘烧杯里加入m克铁粉,当反应停止后,这时天平指针的指向可能是( )A.指针偏向左盘
B.指针偏向右盘
C.指针仍指向“0”
D.以上三种情况都可能存在
【答案】分析:由金属活动性强弱锌>铁>氢,锌、铁都能与盐酸反应放出氢气;根据题意,通过比较mg金属锌、mg金属铁与足量的稀盐酸完全反应放出氢气质量大小,判断天平指针的指向.
解答:解:mg金属锌、mg金属铁与足量的稀盐酸完全反应放出氢气质量大小为:(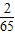 ×mg)<(
×mg)<(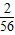 ×mg),由于右边烧杯中加入mg金属铁放出氢气质量大于左边烧杯中加入mg金属锌所放出氢气质量,因此天平指针会偏向于左边.
×mg),由于右边烧杯中加入mg金属铁放出氢气质量大于左边烧杯中加入mg金属锌所放出氢气质量,因此天平指针会偏向于左边.
故选A.
点评:天平是否平衡取决于两端所增加质量的大小,而增加质量大小又取决于等质量金属完全反应放出氢气的多少,这是解答本题时所做判断的依据.
解答:解:mg金属锌、mg金属铁与足量的稀盐酸完全反应放出氢气质量大小为:(
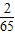 ×mg)<(
×mg)<(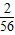 ×mg),由于右边烧杯中加入mg金属铁放出氢气质量大于左边烧杯中加入mg金属锌所放出氢气质量,因此天平指针会偏向于左边.
×mg),由于右边烧杯中加入mg金属铁放出氢气质量大于左边烧杯中加入mg金属锌所放出氢气质量,因此天平指针会偏向于左边.故选A.
点评:天平是否平衡取决于两端所增加质量的大小,而增加质量大小又取决于等质量金属完全反应放出氢气的多少,这是解答本题时所做判断的依据.

练习册系列答案
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案
相关题目
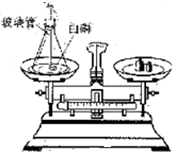 如图是探究质量守恒的实验装置,雅思、敏洁两位同学在底部铺有细沙的锥形瓶中,放入一粒火柴头大的白磷,在锥形瓶口的橡皮塞上安装一根玻璃管,在其上端系牢一个小气球,并使玻璃管下端能与白磷接触.将锥形瓶和玻璃管放在托盘天平上用砝码平衡.然后取下锥形瓶,雅思同学将橡皮塞上的玻璃管放在酒精灯火焰上灼 烧至红热后,迅速用橡皮塞将锥形瓶塞紧,并将白磷引燃.冷却后,称量.观察天平是否平衡.
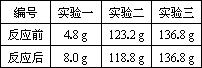
如图是探究质量守恒的实验装置,雅思、敏洁两位同学在底部铺有细沙的锥形瓶中,放入一粒火柴头大的白磷,在锥形瓶口的橡皮塞上安装一根玻璃管,在其上端系牢一个小气球,并使玻璃管下端能与白磷接触.将锥形瓶和玻璃管放在托盘天平上用砝码平衡.然后取下锥形瓶,雅思同学将橡皮塞上的玻璃管放在酒精灯火焰上灼 烧至红热后,迅速用橡皮塞将锥形瓶塞紧,并将白磷引燃.冷却后,称量.观察天平是否平衡. 有人设计如图所示的实验来验证质量守恒定律:把装有硫酸铜溶液的小试管放入盛有氢氧化钠溶液的烧杯中,将烧杯放到托盘天平上,用砝码平衡.取下烧杯并将其倾斜,使两种溶液混合反应,再把烧杯放到天平上,观察天平是否平衡.你认为上述实验设计是否严密?
有人设计如图所示的实验来验证质量守恒定律:把装有硫酸铜溶液的小试管放入盛有氢氧化钠溶液的烧杯中,将烧杯放到托盘天平上,用砝码平衡.取下烧杯并将其倾斜,使两种溶液混合反应,再把烧杯放到天平上,观察天平是否平衡.你认为上述实验设计是否严密?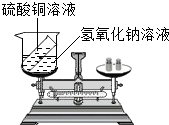 (2013?盐城二模)请你参与某学习小组的探究活动,并回答相关问题.
(2013?盐城二模)请你参与某学习小组的探究活动,并回答相关问题.